
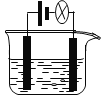
【题目】利用下图装置做下面的实验:在烧杯中盛有半杯乙溶液,然后用滴定管向容器中滴入甲溶液。随着甲的滴入,灯泡逐渐变暗;滴到一定量时,灯泡熄灭,继续滴入甲溶液,灯泡又逐渐变亮。下列各组溶液中,能够产生上述现象的是 ( )
选项 | 甲 | 乙 |
A | NH3·H2O | HCl |
B | CH3COOH | NH3·H2O |
C | NaOH | MgCl2 |
D | H2SO4 | Ba(OH)2 |
A.AB.BC.CD.D
【答案】D
【解析】
电解质溶液的导电性主要与溶液中自由移动的离子浓度和离子所带的电荷以及离子的移动速率有关,浓度越大,所带电荷越多,移动速度越快,导电能力越强。
A.向盐酸HCl中滴加氨水NH3·H2O,原溶液中存在HCl=H++Cl-,加入氨水后反应为NH3·H2O+HCl=NH4Cl+H2O,则NH4Cl=![]() +Cl-,故溶液中自由移动的离子浓度基本不变,灯泡亮度基本不变,随着氨水的加入,离子浓度减小,灯泡变暗,A不合题意;
+Cl-,故溶液中自由移动的离子浓度基本不变,灯泡亮度基本不变,随着氨水的加入,离子浓度减小,灯泡变暗,A不合题意;
B.向NH3H2O中滴加CH3COOH,生成醋酸铵强电解质,溶液中离子浓度增大,电灯渐渐变暗亮,滴到一定量后,继续滴入甲溶液,离子浓度因稀释而减小,电灯又会逐渐变暗,B不合题意;
C.向MgCl2中滴加NaOH,原溶液中存在MgCl2=Mg2++2Cl-,加入NaOH后反应为2NaOH+MgCl2=Mg(OH)2↓+2NaCl,则NaCl=Na++Cl-,此过程中溶液中自由移动的离子浓度基本不变,灯泡亮度基本不变,随着NaOH的加入,离子浓度因稀释而减小,灯泡变暗,C不合题意;
D.向Ba(OH)2中滴加H2SO4,一开始生成沉淀,电灯渐渐变暗甚至熄灭,后来硫酸过量时,电灯又渐渐变亮,D符合题意;
故答案为:D。


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】麻黄素是中枢神经兴奋剂,其合成路线如图所示。
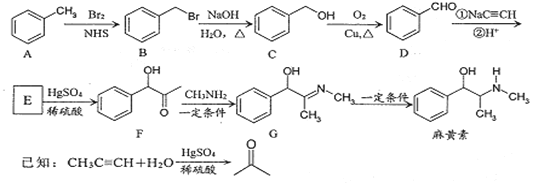
(1)F中的含氧官能团名称为 ________和________。
(2)E的结构简式为 _______。
(3)写出B-C的反应类型:_______。
(4)请写出同时满足下列条件的F的一种同分异构体的结构简式________。
①能发生银镜反应;②水解产物能与FeCl3显色:③核磁共振氢谱显示有四组峰。
(5)请写出以乙醇为原料制备强吸水性树脂 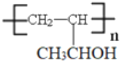 的合成路线流程图________(可选择题干中相关试剂,无机试剂任选,合成路线流程图示例见本题题干)。
的合成路线流程图________(可选择题干中相关试剂,无机试剂任选,合成路线流程图示例见本题题干)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有以下有机物:① ![]() ②
② ![]() ③
③ ![]() ④
④ ![]() ⑤苯酚(填序号)
⑤苯酚(填序号)
(1)能与Na反应的是 ________ ;
(2)能与![]() 溶液反应的有_________;
溶液反应的有_________;
(3)能与NaHCO3溶液反应有气泡产生的是_______________;
(4)能与银氨溶液发生银镜反应的有____________________;
(5)既能发生消去反应,又能发生酯化反应的有___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设 NA 为阿伏加德罗常数的值。下列说法正确的是
A.0.l mol C2H6O 分子中含 C-H 键数目为 0.5 NA
B.1 mol·L-1 的 NH4Cl 溶液中含有![]() 数目小于 0.1 NA
数目小于 0.1 NA
C.25℃时,1 L pH=13 的 Ba(OH)2 溶液中含有 OH-的数目为 0.2NA
D.1 mol Cl2 与足量铜铁合金反应,转移电子数一定是 2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氧化二钴主要用作颜料、釉料及磁性材料,利用铜钴矿石制备Co2O3的工艺流程如图所示。
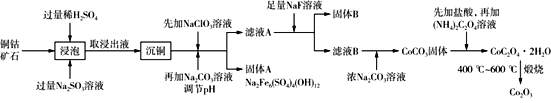
已知:铜钴矿石主要含有CoO(OH)、CoCO3、Cu2(OH)2CO3和SiO2,其中还含有一定量的Fe2O3、MgO和CaO等。请回答下列问题:
(1)“浸泡”过程中可以加快反应速率和提高原料利用率的方法是_______(写出2种即可)。
(2)“浸泡”过程中,加入Na2SO3溶液的主要作用是____________。
(3)向“沉铜”后的滤液中加入NaClO3溶液,写出滤液中的金属离子与NaClO3反应的离子方程式________________。
(4)温度、pH对铜、钴浸出率的影响如图1、图2所示:
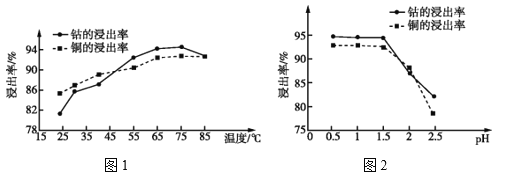
①“浸泡”铜钴矿石的适宜条件为__________________。
②图2中pH增大时铜、钴浸出率下降的原因可能是___________。
(5)CoC2O4·2H2O在空气中高温煅烧得到Co2O3的化学方程式是________。
(6)一定温度下,向滤液A中加入足量的NaF溶液可将Ca2+、Mg2+沉淀而除去,若所得滤液B中c(Mg2+)=1.0×10-5 mol/L,则滤液B中c(Ca2+)为______。[已知该温度下Ksp(CaF2)=3.4×10-11,Ksp(MgF2)=7.1×10-11]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,将一小块钠放在石棉网上加热。回答下列问题:
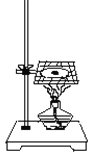
(1)观察到的实验现象有:____________________________________和黑色固体物质生成。
(2)产生以上现象的主要化学反应方程式为:_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚砷酸(H3AsO3)可以用于治疗白血病,其在溶液中存在多种微粒形态,将KOH溶液滴入亚砷酸溶液,各种微粒物质的量分数与溶液的pH关系如图所示。下列说法正确的( )

A.人体血液的pH在7.35~7.45之间,用药后人体中含As元素的主要微粒是AsO33-
B.n(H3AsO3)∶n(H2AsO3-)=1∶1时,溶液显酸性
C.当pH调至11时发生反应的离子方程式是H3AsO3+OH-=H2AsO3-+H2O
D.pH=12时,溶液中c(H2AsO3-)+2c(HAsO32-)+3c(AsO33-)+c(OH-)=c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天门冬氨酸锌是一种补锌剂,可以![]() 、天门冬氨酸(
、天门冬氨酸(![]() )为原料制备。回答下列问题:
)为原料制备。回答下列问题:
(1)Zn成为阳离子时首先失去______轨道电子。碲(Te)与O同主族,则Te元素中电子占据的能量最高的能级是______。
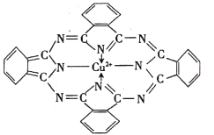
(2)P是N的同族元素,PH3与NH3中稳定性更高的是______(填化学式),其判断理由是______;酞菁铜可用于生产蓝色颜料(结构如图),其中C原子的轨道杂化类型为______。
(3)CO为______(填“极性”或“非极性”)分子。
(4)ZnO晶体的一种晶胞结构如图:
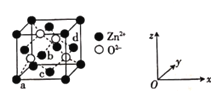
①![]() 的配位数为____________。
的配位数为____________。
②以晶胞边长为单位长度建立的坐标系可表示晶胞中锌原子的位置,称作原子分数坐标。图中原子a的分数坐标为![]() ,原子d的分数坐标为
,原子d的分数坐标为![]() ,则原子b和c的分数坐标分别为______、______。
,则原子b和c的分数坐标分别为______、______。
③设![]() 为阿伏加德罗常数的值。已知晶胞边长为
为阿伏加德罗常数的值。已知晶胞边长为![]() nm,则ZnO晶体的密度为______(列出计算式)
nm,则ZnO晶体的密度为______(列出计算式)![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质结构和性质的叙述不正确的是( )
A.甲苯可以被酸性![]() 溶液氧化成苯甲酸,而乙烷不能被其氧化,说明苯环对侧链产生了影响
溶液氧化成苯甲酸,而乙烷不能被其氧化,说明苯环对侧链产生了影响
B.苯酚能与氢氧化钠溶液反应而乙醇不能,说明苯环对羟基产生了影响
C.二氯甲烷只有一种结构,说明甲烷的分子构型不是平面型
D.间二甲苯只有一种结构,说明苯环中不存在单双键交替出现的结构
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com