
【题目】氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。
(1)下列生产、生活中的事例中没有发生氧化还原反应的是____(填写字母代号)

(2)水是人体的重要组成部分,是人体中含量最多的一种物质。而“四种基本反应类型与氧化还原反应的关系”可用如图表达。
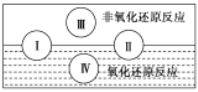
试写出有水参加的符合反应类型Ⅳ的一个化学方程式:_____,其中水为______剂。
(3)过氧化氢俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。H2O2有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称;如消除采矿业胶液中的氰化物(如KCN),经以下反应实现:KCN+H2O2+H2O=A+NH3↑,试指出生成物A的化学式为___,并阐明H2O2被称为绿色氧化剂的理由是_______。
(4)氯化铵常用作焊接。如:在焊接铜器时用氯化铵除去铜器表面的氧化铜以便焊接,其反应为:____CuO+___NH4Cl![]() ____Cu+___CuCl2+___N2↑+___H2O。
____Cu+___CuCl2+___N2↑+___H2O。
①配平此氧化还原反应方程式。
②该反应中,被氧化的元素是______(填元素名称),氧化剂是____(填化学式)。
③反应中若产生0.2mol的气体,则有_____mol的电子转移。
【答案】C C+H2O(g)![]() CO+H2 氧化 KHCO3 H2O2作氧化剂,其还原产物是H2O,H2O没有毒性及污染性 4 2 3 1 1 4 氮 CuO 1.2
CO+H2 氧化 KHCO3 H2O2作氧化剂,其还原产物是H2O,H2O没有毒性及污染性 4 2 3 1 1 4 氮 CuO 1.2
【解析】
(1)发生的反应中含元素的化合价变化,为氧化还原反应;
(2)由图可知,Ⅳ为氧化还原反应,且属于置换反应;
(3)KCN+H2O2+H2O═A+NH3↑中遵循元素、原子守恒,以此推断A的分子式;
(4)Cu由+2价降低为0,N元素的化合价由-3价升高为0,由电子守恒、原子守恒分析;
(1)A.煤的形成发生复杂的物理化学变化,C元素的化合价一定变化,为氧化还原反应,故A不选;
B.太阳能电池工作是太阳能转化为电能的原电池装置,是化学变化,故B不选;
C.简单机械织布,为物理变化,故C选;
D.烧制陶瓷发生复杂的物理化学变化,存在氧化过程,涉及氧化还原反应,如涉及碳的燃烧等,故D不选;
故答案为C;
(2)由图可知,Ⅳ为氧化还原反应,且属于置换反应,如2Na+2H2O=2NaOH+H2↑,水中H元素的化合价降低,则水为氧化剂;
(3)KCN+H2O2+H2O═A+NH3↑中遵循元素、原子守恒,可知生成物A应该是KHCO3,双氧水做氧化剂,还原产物是水,环保无污染,不会向溶液中引入杂质离子,H2O2被称为绿色氧化剂;
(4)①Cu由+2价降低为0,N元素的化合价由-3价升高为0,由电子守恒、原子守恒可知,NH4Cl失去3个电子,而铜得到2个电子,得失电子守恒,NH4Cl前面系数为2,铜前面的系数为3,再结合原子守恒可知,反应为4CuO+2NH4Cl=3Cu+CuCl2+N2+4H2O;
②N元素失去电子被氧化,Cu元素得到电子,则CuO为氧化剂;
③反应中若产生1mol的气体,则有6mol的电子转移,反应中若产生0.2mol的气体,则有1.2mol的电子转移。


科目:高中化学 来源: 题型:
【题目】现有金属单质A、B、C、I和气体甲、乙、丙及物质D、E、F、G、H。其中B是地壳中含量最多的金属。它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
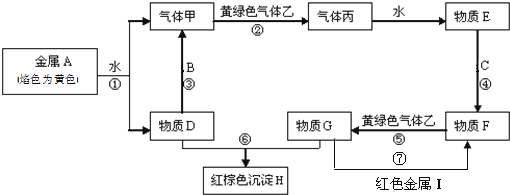
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:C__________、H_________。
(2)写出反应③的化学方程式:___________________。
写出反应⑦的化学方程式:___________________。
写出反应⑥的离子方程式___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A. 向![]() 溶液中滴加氨水至过量:
溶液中滴加氨水至过量:![]()
B. 向![]() 悬浊液中滴加
悬浊液中滴加![]() 溶液:3Mg(OH)2+2Fe3+=2Fe(OH)3+3Mg2+
溶液:3Mg(OH)2+2Fe3+=2Fe(OH)3+3Mg2+
C. 向![]() 溶液中加入足量稀硫酸:2S2O32-+4H+=SO42-+3S↓+2H2O
溶液中加入足量稀硫酸:2S2O32-+4H+=SO42-+3S↓+2H2O
D. 向苯酚钠溶液中通入少量![]() 气体:2C6H5O-+CO2+H2O=2C6H5OH+CO32-
气体:2C6H5O-+CO2+H2O=2C6H5OH+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物W用作调香剂、高分子材料合成的中间体等,制备W的一种合成路线如下。

请回答下列问题:
(1)F的化学名称是________,⑤的反应类型是________。
(2)E中含有的官能团是________(写名称),D聚合生成高分子化合物的结构简式为________。
(3)将反应③得到的产物与O2在催化剂、加热的条件下反应可得D,写出反应④的化学方程式________。
(4)④、⑤两步能否颠倒?________(填“能”或“否”)理由是________。
(5)与A具有含有相同官能团的芳香化合物的同分异构体还有________种(不含立体异构),其中核磁共振氢谱为六组峰,且峰面积之比为1:1:2:2:2:2的结构简式为________。
(6)参照有机物W的上述合成路线,以M和CH3Cl为原料制备F的合成路线(无机试剂任选)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列五组物质:A、 O2和O3 B 、![]() Cl和
Cl和![]() Cl C 、CH4 与C7H16 D、CH3CH2CH2CH3 与
Cl C 、CH4 与C7H16 D、CH3CH2CH2CH3 与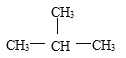 E、
E、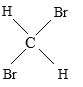 与
与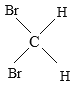
(1)______组两种物质互为同位素;
(2)______组两种物质互为同素异形体;
(3)______组两种物质互为同系物;
(4)______组两种物质互为同分异构体;
(5)______组两种物质实为同一物质。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离平衡曲线如图所示,若以A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度,则下列说法正确的是
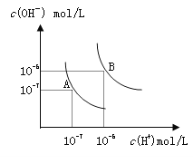
A. 纯水中25℃时的c(H+)比100℃时的c(H+)大
B. 100℃时某溶液中由水电离产生的c(H+)=1×10-11mol/L,则该溶液的pH可能是11或3
C. 将pH=9的Ba(OH)2溶液与pH=4的稀盐酸混合,并保持100℃的恒温,混合溶液的pH=7,则Ba(OH)2溶液和盐酸的体积比为10: 1
D. 25℃时,某Na2SO4溶液中c(SO42-)=5×10-4 mol/L,则溶液中c(Na+):c(OH-)为104:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(乙二酸)可作还原剂和沉淀剂,用于金属除锈、织物漂白和稀土生产。一种制备草酸(含2个结晶水)的工艺流程如右:
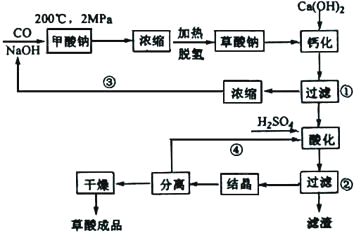
回答下列问题:
(1)CO和NaOH在一定条件下合成甲酸钠、甲酸钠加热脱氢的化学反应方程式分别为:__________________、_______________。
(2)该制备工艺中有两次过滤操作,过滤操作①的滤液是___________,滤渣是________;过滤操作②的滤液是____________和____________,滤渣是_______。
(3)工艺过程中③和④的目的是______________。
(4)有人建议甲酸钠脱氢后直接用硫酸酸化制备草酸。该方案的缺点是产品不纯,其中含有的杂质主要是____________________。
(5)结晶水合草酸成品的纯度用高锰酸钾法测定。
称量草酸成品0.250 g溶于水,用0.0500 mol·L-1的酸性KMnO4溶液滴定,至浅粉红色不消褪,消耗KMnO4溶液15.00 mL,反应的离子方程式为__________________;
列式计算该成品的纯度____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A(g)+C(g)===D(g);ΔH=-Q1kJ/mol,B(g)+C(g)===E(g);ΔH=-Q2kJ/mol,Q1、Q2均大于0,且Q1>Q2,若A与B组成的混合气体 1mol与足量的C反应,放热为Q3kJ,则原混合气体中A与B物质的量之比为( )
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能够表示燃烧热的是( )
A. 2H2(g)+O2(g)=2H2O(g);△H1
B. S(g)+O2(g)= SO2(g);△H2
C. C(s)+![]() O2(g)= CO(g);△H3
O2(g)= CO(g);△H3
D. H2(g)+Cl2(g) = 2HCl(g);△H4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com