
【题目】下列关于燃烧热的描述中正确的是( )
A. 已知a g乙烯气体充分燃烧时生成1 mol CO2和液态水,放出b kJ的热量,则表示乙烯燃烧热的热化学方程式为2C2H4(g)+6O2(g)=4CO2(g)+4H2O(l) ΔH=-4b kJ·mol-1
B. 将甲醇蒸气转化为氢气的热化学方程式是CH3OH(g)+![]() O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1,则CH3OH(g)的燃烧热为192.9 kJ·mol-1
O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1,则CH3OH(g)的燃烧热为192.9 kJ·mol-1
C. H2(g)的燃烧热是285.8 kJ·mol-1,则2H2O(g)=2H2(g)+O2(g) ΔH=+571.6 kJ·mol-1
D. 葡萄糖的燃烧热是2800kJ·mol-1,则![]() C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l) ΔH=-1400kJ·mol-1
C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l) ΔH=-1400kJ·mol-1
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为_______。利用反应6NO2+8NH3![]() 7N2+12H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是______L。
7N2+12H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是______L。
(2)已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH1=﹣196.6 kJmol-1
2SO3(g) ΔH1=﹣196.6 kJmol-1
2NO(g)+O2(g)![]() 2NO2(g) ΔH2=﹣113.0kJmol-1
2NO2(g) ΔH2=﹣113.0kJmol-1
则反应NO2(g)+ SO2(g)![]() SO3(g)+NO(g)的ΔH=________kJmol-1。
SO3(g)+NO(g)的ΔH=________kJmol-1。
一定条件下,将2molNO2与2molSO2置于容积固定的恒温密闭容器中发生上述反应,下列能说明反应达到平衡状态的是__________(填字母)
a.混合气体密度保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1molSO3的同时生成1molNO2
该反应达平衡状态后,若再向该容器充入1molNO2与1molSO2,则SO2的转化率将_______(填“增大”“减小”或“不变”)。
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)![]() CH3OH(g) ΔH=﹣a kJmol-1。在一定温度下,将1molCO(g)和2molH2(g)充入到体积为10L的密闭容器中,发生反应。经过5min达到平衡,此时容器内压强为反应前的0.8倍。则v(CH3OH)为_______,正反应放出的热量为______。
CH3OH(g) ΔH=﹣a kJmol-1。在一定温度下,将1molCO(g)和2molH2(g)充入到体积为10L的密闭容器中,发生反应。经过5min达到平衡,此时容器内压强为反应前的0.8倍。则v(CH3OH)为_______,正反应放出的热量为______。
(4)已知N2O4(g)![]() 2NO2(g) ΔH>0,现将1molN2O4充入一恒压密闭容器中,下列示意图能说明反应达到平衡状态的是_______。
2NO2(g) ΔH>0,现将1molN2O4充入一恒压密闭容器中,下列示意图能说明反应达到平衡状态的是_______。
A.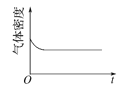 B.
B.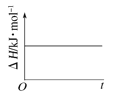 C.
C.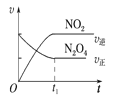 D.
D.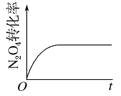
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:

(1)请列举海水淡化的两种方法:________、________。
(2)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的是_________。
(3)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为_______,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是_______。
(4)某化学研究性学习小组为了了解从工业溴中提纯溴的方法,查阅了有关资料知:Br2的沸点为59 ℃,微溶于水,有毒并有强腐蚀性。他们参观生产过程后,画了如下装置简图:

请你参与分析讨论:
①图中仪器B的名称是____________。
②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是__________。
③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件?___________。
④C中液体颜色为________________。为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究氢的获得和应用具有重要意义。
(1)已知:![]() 将0.20molH2S气体充入密闭容器中,保持恒压(p=a)、温度T1条件下进行上述反应。
将0.20molH2S气体充入密闭容器中,保持恒压(p=a)、温度T1条件下进行上述反应。
①下列可以作为反应达到平衡状态的判据是________。
A.气体的平均相对分子质量不变
B.![]()
C.K不变
D.容器体积不变
②![]() 时刻反应达到平衡,H2S的平衡转化率为40%。该反应的平衡常数Kp=________(用a的代数式表示。对于气相反应,用某组分B的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数,记作Kp,如p(B)=p·x(B),p为平衡总压强,x(B)为平衡系统中B的物质的量分数)。
时刻反应达到平衡,H2S的平衡转化率为40%。该反应的平衡常数Kp=________(用a的代数式表示。对于气相反应,用某组分B的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数,记作Kp,如p(B)=p·x(B),p为平衡总压强,x(B)为平衡系统中B的物质的量分数)。
③反应温度T1时,画出0~t2时段,n(S2)随时间变化曲线[n(S2)—t]。保持其它条件不变,改变反应温度为T2(T2>T1),画出0~t2时段,n(S2)随时间变化趋势的曲线[n(S2)—t]________

(2)已知:某催化剂作用下,H2还原NO的反应有两种可能:
Ⅰ.![]()
Ⅱ.![]()
反应历程可以表示为(![]() 表示吸附态)
表示吸附态)
吸附分解:![]() ①
①
![]() ②
②
反应脱附:![]() ③
③
![]() ④
④
![]() ⑤
⑤
其中,反应脱附过程中④与⑤是一组竞争关系,决定了H2还原NO的最终产物。
①如图显示不同温度条件下,原料气![]() ,达到平衡时体系中N2和N2O的含量,由此判断
,达到平衡时体系中N2和N2O的含量,由此判断![]() ________0(填“>”或“<”);判断反应脱附过程中④与⑤两步反应的活化能高低并说明理由________。
________0(填“>”或“<”);判断反应脱附过程中④与⑤两步反应的活化能高低并说明理由________。

②如图显示不同温度条件下,原料气![]() 分别为1、2、3(对应图中标注“1”、“2”、“3”),达到平衡时,体系中N2和N2O的含量,由此可知,增加H2的量,可以增加________的选择性(填“N2”或“N2O”)
分别为1、2、3(对应图中标注“1”、“2”、“3”),达到平衡时,体系中N2和N2O的含量,由此可知,增加H2的量,可以增加________的选择性(填“N2”或“N2O”)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)比较元素非金属性的相对强弱:![]() ________
________![]() (填“>”、“<”或“=”);用一个化学方程式说明
(填“>”、“<”或“=”);用一个化学方程式说明![]() 与
与![]() 氧化性的相对强弱________。
氧化性的相对强弱________。
(2)离子化合物![]() 可被用于治疗消化道疾病,各原子均满足8电子稳定结构。写出
可被用于治疗消化道疾病,各原子均满足8电子稳定结构。写出![]() 的电子式________。
的电子式________。
(3)半导体材料单晶硅的熔点高、硬度大,主要原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学反应速率的说法中,不正确的是( )
A.化学反应速率是衡量化学反应进行快慢程度的物理量
B.在容积不变的反应器中,化学反应速率通常用单位时间内反应物浓度的减少或生成物浓度的增加来表示
C.若某化学反应的反应速率为![]() ,就是指在该时间内反应物和生成物的浓度变化都为
,就是指在该时间内反应物和生成物的浓度变化都为![]()
D.化学反应速率是可以通过实验测定的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将煤直接作为燃料燃烧,不但热效率较低,且产生烟尘、二氧化硫、氮的氧化物等,带来严重的环境污染。煤干馏是提高煤利用率、生产重要化工原料、降低污染物排放量的有效措施之一。
某化学学习小组在实验室条件下探究煤干馏的现象及产物,装置如下,请回答有关问题:
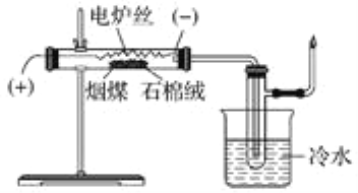
(1)煤干馏的条件是________________________________________________________
(2)盛有冷水的烧杯的作用是________________________________________________。
(3)实验后检验生成粗氨水的操作是_________________________________________。
(4)已知一氧化碳不能使溴水褪色,若将具支试管出来的气体通入溴水中,发现溴水褪色,则说明产生了_____________________________________________________________。
(5)检验具支试管出来的气体的性质后,将尾气点燃,火焰的颜色为______________。
(6)从煤焦油中分离出苯及其同系物的实验方法是_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是工业电解饱和食盐水的装置示意图,下列有关说法不正确的是
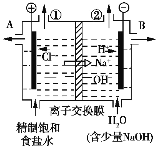
A. 装置中的离子交换膜只能让阳离子通过,不能让阴离子通过
B. 装置中出口①处的物质是氢气,出口②处的物质是氯气
C. 除去杂质后的氢氧化钠溶液从出口B处导出
D. 转移0.8 mol电子时产生氢气8.96 L(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】该装置为锂钒氧化物二次电池,其成本较低,对环境无污染:![]() 在下图中用该电池电解含镍酸性废水可得到单质镍(已知:
在下图中用该电池电解含镍酸性废水可得到单质镍(已知:![]() )。下列说法不正确的是( )
)。下列说法不正确的是( )
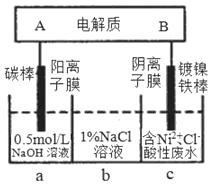
A.该电池充电时,A电极的电极反应式为![]()
B.电解过程中,b中NaCl溶液的物质的浓度会增大
C.当锂钒氧化物二次电池中有7gLi参与放电时,一定能得到29.35g镍
D.锂钒氧化物二次电池一般用非水溶液作为电解液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com