
在实验室中电解500ml某0.03mol/L的NaCl溶液,通电一段时间后溶液的pH值从7增加到12时(设电解时溶液的体积变化忽略不计),阴极产生________ml气体(标况),溶液中NaCl的浓度为________mol/L.
科目:高中化学 来源:福建省师大附中2011-2012学年高二下学期期中考试化学试题 题型:022
(1)高纯铜(纯度可达99.99%)广泛应用于电器工业.某粗铜样品中含Fe、Ni、Ag、Au等四种金属杂质,可用电解法进行精炼制得高纯铜.请在下图中标明电极材料和电解质溶液的名称

已知Ni的金属活动性介于Fe和Sn之间.则精炼完成后,在阳极底部的沉积物中可回收到的金属为________(填化学式).
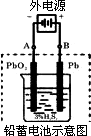
(2)若在实验室中完成此实验,可用铅蓄电池做电源.铅蓄电池的电池总反应式为:
2PbSO4+2H2O在完全放电耗尽PbO2和Pb时,若按下图所示连接进行充电,充电一段时间后,则在A电极上生成________(填化学式),B电极上生成________(填化学式);充电完毕,铅蓄电池的正极是________极(填“A”或“B”)
(3)在如图用石墨作电极的电解池中,放入500 mL含一种溶质的某蓝色稀溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量,电极增重0.16 g.请回答下列问题:
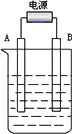
①B电极的反应式________.
②原溶液的物质的量浓度是________;电解后溶液的pH为________.(假设电解前后溶液的体积不变)
查看答案和解析>>
科目:高中化学 来源:学习高手选修化学(反应原理人教版) 人教版 题型:038
在实验室中,电解500 mL某0.03 mol·L-1的NaOH溶液,通电一段时间后,溶液的pH从7增加到12时(溶液体积变化忽略)阴极产生多少毫升气体(标准状况),溶液中NaCl浓度为多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(19分)高锰酸钾是锰的重要化合物和常用的氧化剂。以下是实验室中模拟工业上用软锰矿制备高锰酸钾的流程图。
(1)操作Ⅰ的名称为 ;操作Ⅲ的名称为 。
(2)反应②的化学方程式为 。工业上用上述原理生产KMnO4方法产率较低,较好的制备方法是电解法。用Pt作阳极,Fe作阴极,K2MnO4为电解液,阳极的电极反应式为 。
(3)KMnO4是一种较稳定的化合物,但日光对KMnO4溶液的分解有催化作用,生成MnO2、KOH和O2。而MnO2也是该分解反应的一种催化剂,请你设计一个实验方案,验证MnO2对该分解反应具有催化性: 。
(4)KMnO4在酸性介质中的强氧化性广泛应用于分析化学中。
例如:2KMnO4+3H2SO4+5Na2SO35Na2SO4+K2SO4+2MnSO4+3H2O。某同学用KMnO4测定实验室长期存放的Na2SO3固体的纯度。现欲准确称取6.3 gNa2SO3固体样品,配成500 mL溶液。取25.00 mL上述溶液放入锥形瓶中,用0.01000 mol/L 的酸性KMnO4溶液进行滴定。滴定结果如下表所示:
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 mL | 0.02 | 24.01 |
| 2 | 25.00 mL | 0.70 | 24.71 |
| 3 | 25.00 mL | 0.20 | 24.20 |
①配制500 mLNa2SO3溶液时,必须用到的实验仪器有:烧杯、玻璃棒、胶头滴管、药匙和 、 。
②判断滴定终点的依据是 。
③下列操作会导致测定结果偏高的是
A.未用标准浓度的酸性KMnO4溶液润洗滴定管
B.滴定前锥形瓶未干燥
C.滴定前滴定管尖嘴部分有气泡
D.观察读数时,滴定前仰视,滴定后俯视
④用上述实验数据,计算Na2SO3的纯度为 。
查看答案和解析>>
科目:高中化学 来源:2010年浙江省高二第二学期期中考试(1-3班)化学试题 题型:填空题
(19分)高锰酸钾是锰的重要化合物和常用的氧化剂。以下是实验室中模拟工业上用软锰矿制备高锰酸钾的流程图。
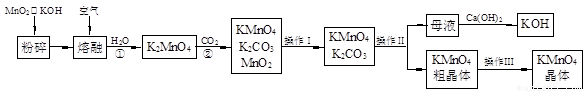
(1)操作Ⅰ的名称为 ;操作Ⅲ的名称为 。
(2)反应②的化学方程式为 。工业上用上述原理生产KMnO4方法产率较低,较好的制备方法是电解法。用Pt作阳极,Fe作阴极,K2MnO4为电解液,阳极的电极反应式为 。
(3)KMnO4是一种较稳定的化合物,但日光对KMnO4溶液的分解有催化作用,生成MnO2、KOH和O2。而 MnO2也是该分解反应的一种催化剂,请你设计一个实验方案,验证MnO2对该分解反应具有催化性: 。
(4)KMnO4在酸性介质中的强氧化性广泛应用于分析化学中。
例如:2KMnO4+3H2SO4+5Na2SO35Na2SO4+K2SO4+2MnSO4+3H2O。某同学用KMnO4测定实验室长期存放的Na2SO3固体的纯度。现欲准确称取6.3 g Na2SO3固体样品,配成500 mL溶液。取25.00 mL上述溶液放入锥形瓶中,用0.01000 mol/L 的酸性KMnO4溶液进行滴定。滴定结果如下表所示:
|
滴定次数[来源:][来源:Z&xx&k.Com] |
待测溶液的体积/mL[来源:学#科#网Z#X#X#K] |
标准溶液的体积[来源:] |
|
|
滴定前刻度/mL |
滴定后刻度/mL |
||
|
1 |
25.00 mL |
0.02 |
24.01 |
|
2 |
25.00 mL |
0.70 |
24.71 |
|
3 |
25.00 mL |
0.20 |
24.20 |
①配制500 mLNa2SO3溶液时,必须用到的实验仪器有:烧杯、玻璃棒、胶头滴管、药匙和 、 。
②判断滴定终点的依据是 。
③下列操作会导致测定结果偏高的是
A.未用标准浓度的酸性KMnO4溶液润洗滴定管
B.滴定前锥形瓶未干燥
C.滴定前滴定管尖嘴部分有气泡
D.观察读数时,滴定前仰视,滴定后俯视
④用上述实验数据,计算Na2SO3的纯度为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com