
 在100℃时,将0.100mol的四氧化二氨气体充入1L恒容抽空的密闭容器中,隔一定时间对该容器内的物质浓度进行分析得到表数据:
在100℃时,将0.100mol的四氧化二氨气体充入1L恒容抽空的密闭容器中,隔一定时间对该容器内的物质浓度进行分析得到表数据:| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| c(N2O4)/mol•L-1 | 0.100 | c1 | 0.050 | 0.040 | 0.040 |
| c(NO2)/mol•L-1 | 0.000 | 0.060 | c2 | 0.120 | 0.120 |
分析 (1)平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积,根据方程式计算c2、c1,据此解答;60s后反应达平衡,反应混合物各组分的浓度不变;
(2)依据起始浓度,平衡浓度和图表中的浓度,描点画出变化图象;
(3)由表可知,60s时反应达平衡,根据方程式计算△c(N2O4),依据化学反应速率V=$\frac{△c}{△t}$计算得到;
(4)N2O4(g)?2NO2(g),随温度升高,混合气体的颜色变深说明平衡正向进行;
(5)达平衡后下列条件的改变可使NO2气体浓度增大的是平衡正向进行;
(6)依据图表数据计算平衡常数,若起始时充入NO2气体0.080mol,N2O4气体0.010mol,计算此时浓度商和平衡常数比较平衡平衡进行的方向.
解答 解:(1)N2O4(g)?2NO2(g),反应的平衡常数K=$\frac{{c}^{2}(N{O}_{2})}{c({N}_{2}{O}_{4})}$;
20s时c(NO2)=0.060mol/L
N2O4?2 NO2,
浓度变化 0.030mol 0.060mol/L
c1=0.10mol/L-0.03mol/L=0.070mol/L;
由表可知,40s时,c(N2O4)=0.050mol/L,
N2O4?2 NO2,
浓度变化:(0.1-0.05)mol/L 0.10mol/L
所以c2=0.10mol/L
所以c2>c1,故答案为:$\frac{{c}^{2}(N{O}_{2})}{c({N}_{2}{O}_{4})}$;<;
(2)依据图表中物质的浓度在坐标系中描点画出变化图象,平衡状态(NO2)=0.120mol/L,c(N2O4)=0.10mol/L-0.060mol/L=0.04mol/L,得到的图象为: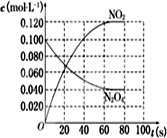 ,
,
故答案为: ;
;
(3)由表可知,60s时反应达平衡,c(NO2)=0.120mol/L,
N2O4?2 NO2,
浓度变化:0.06mol/L 0.120mol/L
V(N2O4)=$\frac{0.060mol/L}{69s}$=0.001mol/(L•s);
故答案为:0.001;
(4)N2O4(g)?2NO2(g),随温度升高,混合气体的颜色变深说明平衡正向进行,正反应为吸热反应,△H>0,
故答案为:>;
(5)N2O4?2 NO2,
A.增大容器的容积,压强减小平衡正向进行,但体积增大为主,二氧化氮浓度减小,故A错误;
B.再充入一定量的N2O4,平衡正向进行二氧化氮难度增大,故B正确;
C.分离出一定量的NO2 ,平衡正向进行,二氧化氮难度减小,故C错误;
D.再充入一定量的He,总压增大,分压不变,平衡不变,二氧化氮浓度不变,故D错误;
故答案为:B;
(6)依据平衡浓度计算平衡常数,
N2O4?2 NO2,
起始量(mol/L) 0.10 0
变化量(mol/L) 0.06 0.12
平衡量(mol/L) 0.04 0.12
K=$\frac{0.1{2}^{2}}{0.04}$=0.36,
若起始时充入NO2气体0.080mol,N2O4气体0.010mol,Qc=$\frac{0.0{8}^{2}}{0.01}$=0.64>K=0.36,平衡逆向进行,
答:计算判断反应进行的方向是逆向进行.
点评 本题考查化学平衡的有关计算、化学平衡的影响因素与平衡图象分析,平衡常数计算应用,注意基础知识的积累掌握,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 氟化氢的电子式: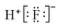 | |
| B. | 氯原子的结构示意图: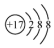 | |
| C. | 丙烯的结构简式:C3H6 | |
| D. | 硫原子的最外层电子排布式:3s23p4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (CH3)2CHCH2CH3 | B. | CH3CH2CH2CH2CH3 | C. | (CH3)2CHCH(CH3)2 | D. | (CH3)3CCH2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化铜跟硝酸反应:CuO+2H+═Cu2++H2O | |
| B. | NO2气体与水反应:2NO2+H2O═2H++NO3-+NO↑ | |
| C. | 硫酸和氢氧化钡溶液反应:SO42-+H++OH-+Ba2+═BaSO4↓+H2O | |
| D. | AlCl3溶液中加入氨水:Al3++3OH-═Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铯的密度比水小,像钠一样浮在水面上 | |
| B. | 铯与水反应十分剧烈,甚至会发生爆炸 | |
| C. | 碳酸铯加热时易分解成二氧化碳和氧化铯 | |
| D. | 氢氧化铯是强碱,其碱性比氢氧化钾弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有第3列到第12列全部是金属元素 | |
| B. | 元素周期表共有7个周期,16个族 | |
| C. | 周期数大于或等于族的序数时,一定是金属元素 | |
| D. | 是按原子的质量数由小到大的顺序编制的 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 过氧化钠与二氧化碳反应时,生成0.1mol氧气转移的电子数为0.4NA | |
| B. | 标准状况下,22.4LH2O含有2NA个共价键 | |
| C. | 常温下,23g NO2含有NA个氧原子 | |
| D. | 1mol ${\;}_{8}^{18}$O2的中子数是20 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com