
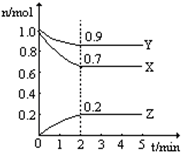
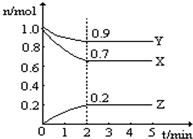
某温度时, 在一个0.5 L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。
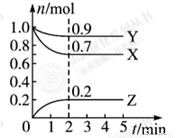
根据图中数据回答下列问题:
(1)该反应的化学方程式为 。
(2)反应开始至2 min,以气体Z表示的平均反应速率为 。
(3)用物质X表示的化学反应速率为0.2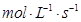 与用物质Y表示的化学反应速率为0.1
与用物质Y表示的化学反应速率为0.1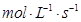 ,哪个快?( )
,哪个快?( )
a.前者 b.后者 c.一样快 d.无法比较
(4)若X、Y、Z均为气体,2 min后反应达到平衡,反应达平衡时:
①此时体系的压强是开始时的 倍;
②达平衡时,容器内混合气体的平均相对分子质量比起始投料时 (填“增大”“减小”或“相等”)。
(12分)(1) 3X + Y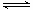 2Z [3分] (2)0.2mol•L-1•min-1 [2分]
2Z [3分] (2)0.2mol•L-1•min-1 [2分]
(3) b [2分] (4)0.9[3分] (5)增大[2分]
【解析】
试题分析:(1)由图象可以看出,反应中X、Y的物质的量减小,Z的物质的量增多,则X、Y为反应物,Z为生成物,且△n(X):△n(Y):△n(Z)=0.3mol:0.1mol:0.2mol=3:1:2,则反应的化学方程式为:3X+Y 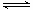 2Z。(2)在2min时间内,用Z表示反应的平均速率v(Z)=
2Z。(2)在2min时间内,用Z表示反应的平均速率v(Z)=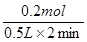 =0.2mol/(L•min)。
=0.2mol/(L•min)。
(3)因为反应速率之比是相应的化学计量数之比,所以如果用物质X表示的化学反应速率为0.2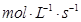 ,则根据方程式可知,用物质Y表示的反应速率是0.2mol/(L•min)÷3=0.067mol/(L•min)<0.1mol/(L•min),因此后者反应速率快,答案选b。
,则根据方程式可知,用物质Y表示的反应速率是0.2mol/(L•min)÷3=0.067mol/(L•min)<0.1mol/(L•min),因此后者反应速率快,答案选b。
(4)①根据图像可知,平衡时XYZ的物质的量分别是(mol)0.7、0.9和0.2,所以此时体系的压强是开始时的(0.7+0.9+0.2)÷2=0.9倍。
②正方应是体积减小的,而气体的质量不变,所以达平衡时,容器内混合气体的平均相对分子质量比起始投料是增大。
考点:考查化可逆反应的有关计算、化学平衡图象分析
点评:该题是中等难度的试题,试题基础性强,侧重对学生灵活运用基础知识解决实际问题的能力的培养。答题注意分析各物质的量的变化曲线,把握化学方程式的判断方法。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
 某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白: 2 Z
2 Z 2 Z
2 Z查看答案和解析>>
科目:高中化学 来源: 题型:
 某温度时,在一个2L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
某温度时,在一个2L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白: 2Z
2Z 2Z
2Z查看答案和解析>>
科目:高中化学 来源: 题型:
 某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线,如图所示.根据图中数据,试填写下列空白:
某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线,如图所示.根据图中数据,试填写下列空白: 2Z
2Z 2Z
2Z查看答案和解析>>
科目:高中化学 来源: 题型:
 某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据填空:
某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据填空: 2Z
2Z 2Z
2Z查看答案和解析>>
科目:高中化学 来源: 题型:
 某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白: 2Z
2Z 2Z
2Z查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com