
����Ŀ��ij�Ƽ��ƵõĴ����к���NaHCO3��NaCl���ʡ�ijʵ��С��Դ˼���Ʒ���м�顣
��1��ȡ�˼���Ʒ10g�����ȵ��������ټ��٣���ȴ���أ��Ƶ�����Ϊ9.845g������Ʒ��NaHCO3����������Ϊ__________________________��
��2����ȡ10g������Ʒ��������ˮ�ܽ⣬���250mLһ�����ʵ���Ũ�ȵ���Һ�����ƹ����б���ʹ�õĻ�ѧ������______________________������ĸ��
A.�ձ� B.250mL����ƿC.©�� D.��ͷ�ι� E.������ F.�Թ�
��3����ȡ�������ƺõ���Һ25mL�������м������������ ���ٲ������ݣ����ռ���190.4mL����״�������壬�÷�Ӧ���̵����ӷ���ʽΪ______________________��_______________________��10g����Ʒ�к�____________gNaCl
���𰸡�4.2% ABDE CO32-+2H+=CO2��+H2O HCO3-+H+=CO2��+H2O 1.1
��������
��1����ϲ��������㣻
��2��������Һ����������ܽ⡢��ȴ��ת�ơ����ݣ��Դ��ж�������
��3������Na2CO3+2HCl=2NaCl+CO2��+H2O��NaHCO3+HCl=2NaCl+CO2��+H2O�����������ԭ���غ���㡣
��1��ȡ�˼���Ʒ10g�����ȵ��������ټ��٣���ȴ���أ��Ƶ�����Ϊ9.845g����������10g-9.845g=0.155g��

���m=0.42g������Ʒ��NaHCO3����������Ϊ![]() ��100%=4.2%��
��100%=4.2%��
�ʴ�Ϊ��4.2%��
2�����250mLһ�����ʵ���Ũ�ȵ���Һ����Ҫ�ձ���250mL����ƿ����ͷ�ιܡ���������
�ʴ�Ϊ��ABDE��
��3�������ᷢ�������ӷ�ӦΪCO32-+2H+=CO2��+H2O��HCO3-+H+=CO2��+H2O��10g��Ʒ�к�NaHCO3������Ϊ0.42g����Na2CO3������Ϊ![]() =8.48g������Ʒ��NaCl������Ϊ10g-8.48g-0.42g=1.1g��
=8.48g������Ʒ��NaCl������Ϊ10g-8.48g-0.42g=1.1g��
�ʴ�Ϊ��CO32-+2H+=CO2��+H2O��HCO3-+H+=CO2��+H2O��1.1��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧ����ʽ�У�������ȷ���ﷴӦ��ɫ�仯��ԭ�����
A. ͭ���ÿ����б��������ɫ���壺2Cu��O2��CO2��H2O�TCu2(OH)2CO3
B. ij�ֻ�������������N2O4���ݳ���������ɫ���壺N2O4![]() 2NO2
2NO2
C. FeSO4��7H2O�ڿ����о��ñ�ƣ�2FeSO4��7H2O![]() Fe2O3��SO2����SO3����14H2O
Fe2O3��SO2����SO3����14H2O
D. SO2ͨ��KMnO4��Һ�У���Һ��ɫ����ȥ��5SO2��2KMnO4��2H2O�TK2SO4��2MnSO4ʮ2H2SO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС��Ϊ����ȡ��̽�����������ʣ�����ͼװ�ý���ʵ�飬��ȡ������ԭ����2NH4Cl+Ca(OH)2![]() CaCl2+2NH3��+2H2O,����˵������ȷ���ǣ� ��
CaCl2+2NH3��+2H2O,����˵������ȷ���ǣ� ��
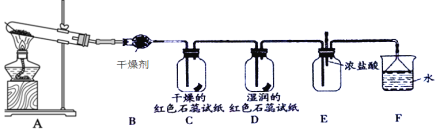
A.װ��B�еĸ����������P2O5B.װ��C�е���ֽ����ɫ��D����ֽ����ɫ
C.��װ��E�е��뼸��Ũ�������ְ���D.װ��F�е�©���������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������X����Y��Һ�У����ɳ��������ʵ���n2������X�����ʵ���n1�Ĺ�ϵ��ͼ��ʾ��������ͼ��ʾ�������
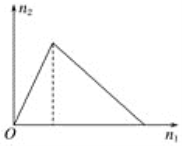
A. XΪ�������ƣ�YΪ�Ȼ���
B. XΪ�Ȼ�����YΪ��������
C. XΪ���ᣬYΪ���ǻ���������
D. XΪ���ǻ��������ƣ�YΪ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Fe2O3��Cu2O���Ǻ�ɫ��ĩ,����������.ʵ��С��ͨ��ʵ����̽��ijһ��ɫ��ĩ��Fe2O3��Cu2O�ĺ���(������������)��
��֪��Cu2O��H2SO4��Cu��Cu SO4��H2O
̽���������£�
ȡ�����÷�ĩ���� ����ϡ�����У���ĩ��ȫ�ܽ⡣
��1�������μ�KSCN�Լ�����Һ����Ϊ��ɫ����Fe2O3��Cu2O�����ʵ���֮��Ϊ________��
��ʵ��С�鷢�ֿ�ͨ���Է�Ӧ����Һ�ij���������̷����壨FeSO4��7H2O��������˼�����������̷����Ʊ���
���Һ![]() ����
����![]() һϵ�в���
һϵ�в���![]() �̷����壨FeSO4��7H2O��
�̷����壨FeSO4��7H2O��
�Լ�aΪ_____________���ѧʽ������һϵ�в�����Ϊ__________��__________�����ˡ�ϴ�ӡ����
��2���ⶨCu2O��������������ȡһ����Fe2O3��Cu2O��ɵĹ�������9.28g��������ڿ����г�ּ��ȣ�ֻ����Cu2O��CuO�ķ�Ӧ�������������ٱ仯ʱ���������Ϊ9.60g�������������Cu2O����������Ϊ_________________��������λ��Ч���֣�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����50mL NaOH��Һ����ͨ��һ������CO2��������Һ������䣩�����ȡ����Һ10mL������ϡ����100mL�������ϡ�ͺ����Һ����μ���0.1mol��L��1�����ᣬ����CO2������������״���£��������������������ϵ��ͼ�����з����������( )

A.OA����������Ӧ�����ӷ���ʽ��H++OH����H2O��CO32��+H+��HCO3��
B.NaOH������CO2��������Һ������ΪNaOH��Na2CO3�������ʵ���Ũ��֮��Ϊ1��1
C.������CO2�������״���£�Ϊ0.056 L
D.ԭNaOH��Һ�����ʵ���Ũ��Ϊ0.5 mol��L��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڸոչ�ȥ��һ���У������������뻯ѧ��صĴ��¼�������˵����ȷ���ǣ�������
A.����Ϊ��ʷ������������![]() ����������
����������![]() ��ʽʵʩ������Ҫ���û�ѧԭ����Դͷ�ϼ��ٺ�������ҵ�����Ի�������Ⱦ
��ʽʵʩ������Ҫ���û�ѧԭ����Դͷ�ϼ��ٺ�������ҵ�����Ի�������Ⱦ
B.���۱�ը�¹ʾ�Ԯ�����У�����Ա�����ִ�Ž����ơ���ʯ���ױ������������Ȼ�ѧƷ�IJֿ����Ӧ��������ĭ�������������
C.����������֯��Ϊ������![]() �ṹ��ͼ��ʾ
�ṹ��ͼ��ʾ![]() �����Ʒ��ǵ�������ű������Ч���ֶΣ����������������Ѿ��������ϰ�������
�����Ʒ��ǵ�������ű������Ч���ֶΣ����������������Ѿ��������ϰ�������
D.ijƷ�ƻ�ױƷ�ڹ���з���ǿ����Ʒ�в����κλ�ѧ�ɷ֣�����ʮ��רע��Ȼ�����������ʲ�Ʒ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������꿱�⣬2018��11��23��ʡ��Ȼ��Դ��������Ϣ��������������ش�ͭ�������ش�ʵ�����塣�Ի�ͭ��(��Ҫ�ɷ�ΪCuFeS2,��������PbS��Al2O3��SiO2)Ϊԭ����ȡ��������������ͼ��

��֪��������Ksp[Fe(OH)3]=8.0��10-38, Ksp[Al(OH)3]=3.0��10-33��Ksp[Cu(OH)2]=3.0��10-20��
��1��CuFeS2����Ԫ�صĻ��ϼ�Ϊ______����Ԫ�������ڱ��е�λ����______________��д����������������������淋����ӷ���ʽ��_______________________________��
��2�����ʺϵ��Լ�A��________��д��ѧʽ����Һ������2�ijɷ�ΪPbSO4��_______�����Լ�A��Ũ��Ϊ6mol��L-1ʱ ����������ʵ���У�ͭ�Ľ����ʽ����ͼ��ʾ�������õ����ʵ������(�¶ȡ�ʱ��)Ϊ_______________��

��3�����ʺϵ��Լ�B��_______(�����)�����ʺϵ��Լ�C��______������ţ�������3�ijɷ�Ϊ_________________________��
a��Cl2 b��CuO c�����Ը��������Һ d��NaOH e��H2O2 ��Һ f��K2CO3
��4������1����ʵ�����н��У��õ��IJ����������ձ�����������_______������2�IJ���Ϊ________________���ˡ�ϴ�ӡ�
��5��������֪��Ϣ������㣺��Fe3+��ȫ����ʱ����Һ��Al3+�������Ũ��Ϊ______������ʾ��������Ũ����1��10-5mol��Lʱ����Ϊ�����ӳ�����ȫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������ˮ(PO43����HPO42����H2PO4����NH4����NH3��H2O��)���������ʯ��һ�ֹ����������£�����˵���������
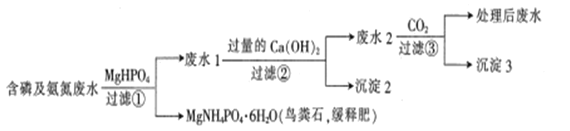
A. ��ȥˮ���е��Ͱ����ɷ�ֹˮ�帻Ӫ�������ɻ������õ���
B. MgNH4PO4��6H2O���ܽ�ȱ�MgHPO4��С
C. �����ˢ����õ��ġ�����2"��Ca3(PO4)2��Mg(OH)2
D. Ϊ�����̣��ɽ��٢ڢ۵Ĺ��˲���ϲ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com