
【题目】2SO2(g)+O2(g)===2SO3(g)反应过程的能量变化如图所示。
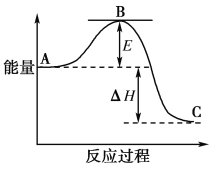
已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ·mol-1。请回答下列问题:
(1)图中A、C分别表示______________、________________,E的大小对该反应的反应热________(填“有”或“无”)影响;
(2)该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?________,理由是________________________________________________________________________________;
(3)图中ΔH=________kJ·mol-1;
(4)已知单质硫的燃烧热ΔH=-296 kJ·mol-1,计算由S(s)生成1 mol SO3(g)的ΔH________(写出计算过程)。
【答案】反应物总能量 生成物总能量 无 降低 催化剂(V2O5)改变了反应的历程,使活化能E降低 -198 S(s)+O2(g)===SO2(g) ΔH1=-296 kJ·mol-1,
SO2(g)+1/2O2(g)===SO3(g) ΔH2=-99 kJ·mol-1,
S(s)+3/2O2(g)===SO3(g) ΔH=ΔH1+ΔH2=-395 kJ·mol-1
【解析】
(1)A、C分别表示反应物总能量的生成物总能量,B为活化能,活化能的大小与反应热无关;
(2)加入催化剂,活化能减小,反应反应热不变;
(3)由1molSO2(g)氧化为1molSO3(g)的ΔH=-99kJ·mol-1可知2SO2(g)+O2(g)=2SO3(g) ΔH=-198kJ·mol-1;
(4)单质硫的燃烧热为296KJmol-1,所以热化学方程式为:S(s)+O2(g)═SO2(g)△H=-296kJ/mol,利用盖斯定理解答该题。
(1)因图中A、C分别表示反应物总能量、生成物总能量,B为活化能,反应热是A、C所具有的总能量之差,活化能的大小与反应热无关,
故答案为:反应物总能量;生成物总能量;无。
(2)催化剂降低反应的活化能加快反应的速率,但不能改变反应热,催化剂(V2O5)改变了反应的历程,使活化能E降低;故答案为:降低,催化剂(V2O5)改变了反应的历程,使活化能E降低。
(3)因为1molSO2(g)氧化为1molSO3(g)的ΔH=-99kJ·mol-1,所以2molSO2(g)氧化为2molSO3(g)的ΔH=-198kJ·mol-1,则2SO2(g)+O2(g)=2SO3(g) ΔH=-198kJ·mol-1,故答案为:-198。
(4)因单质硫的燃烧热为296kJmol-1,则S(s)+O2(g)=SO2(g)△H=-296kJmol-1,
而1molSO2(g)氧化为1molSO3的△H=-99kJmol-1,则SO2(g)+1/2O2(g)=SO3(g)△H=-99kJmol-1,由盖斯定律可得:S(s)+3/2O2(g)=SO3(g)△H=-296kJmol-1+(-99kJmol-1)=-395kJmol-1,
故答案为:S(s)+O2(g)=SO2(g) ΔH1=-296kJ·mol-1,SO2(g)+1/2O2(g)=SO3(g) ΔH2=-99kJ·mol-1,S(s)+3/2O2(g)=SO3(g) ΔH=ΔH1+ΔH2=-395 kJ·mol-1。


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
【题目】室温下,某一元弱酸HA的电离常数![]() 。 向
。 向![]() 浓度约为
浓度约为![]() 溶液中逐滴加入
溶液中逐滴加入![]() 的标准NaOH溶液,其pH变化曲线如图所示
的标准NaOH溶液,其pH变化曲线如图所示![]() 忽略温度变化
忽略温度变化![]() 。请回答下列有关问题:
。请回答下列有关问题:

(1)a、b、c、d四点中水的电离程度最大的是________点,滴定过程中宜选用__________作指示剂,滴定终点在________(填“c点以上”或“c点以下”)。
(2)滴定时,左手控制滴定管,右手摇动锥形瓶,眼睛注视______________________,滴定终点的现象为_____________________________________________________。
(3)若滴定结束时,滴定管中的液面如图所示,则其读数为___________mL。

(4)滴定过程中部分操作如下,下列各操作使测量结果偏高的是____________(填字母序号)。
A.滴定前碱式滴定管未用标准NaOH溶液润洗
B.用蒸馏水洗净锥形瓶后,立即装入HA溶液后进行滴定
C.滴定过程中,溶液出现变色后,立即停止滴定
D.滴定结束后,仰视液面,读取NaOH溶液体积
(5)若重复三次滴定实验的数据如下表所示,计算滴定所测HA溶液的物质的量浓度为_____![]() 。
。
实验序号 | NaOH溶液体积 | 待测HA溶液体积 |
1 | 21.01 | 20.00 |
2 | 20.99 | 20.00 |
3 | 21.60 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:①C(s)+O2 (g)=CO2 (g);△H1,
②C(s)+1/2O2 (g)=CO (g) ;△H2
③C(s)+CO2 (g)=2CO(g) ;△H3
④4Fe(s)+3O2(g)=2Fe2O3(s) ;△H4
⑤3CO (g)+Fe2O3(s)=2Fe(s)+3CO2(g) ;△H5。下列叙述正确的是
A. △H4是Fe的燃烧热B. △H1>△H2
C. △H3=2△H2-△H1D. 3△H1-3△H2-![]() △H4+△H5=0
△H4+△H5=0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中进行如下反应:2X(g)+Y(g)![]() 2Z(g),若要使平衡时反应物总物质的量与生成物的总物质的量相等,且用X、Y作反应物,则X、Y的初始物质的量之比的范围应满足
2Z(g),若要使平衡时反应物总物质的量与生成物的总物质的量相等,且用X、Y作反应物,则X、Y的初始物质的量之比的范围应满足
A. 1< n(X)/n(Y)<3 B. 1/4< n(X)/n(Y)<2/3
C. 2/3< n(X)/n(Y)<4 D. 1/4< n(X)/n(Y)<3/2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的有( )个
①20℃,101kPa,22.4LCl2通入足量的NaOH溶液充分反应,有NA个电子转移
②64g灼热的铜丝在硫黄蒸气里完全反应后,失去的电子数为2NA
③标准状况下,NA个NO分子和0.5NA个O2分子充分反应后气体体积为22.4 L
④7.8g Na2S与Na2O2的混合物中阴离子数大于0.1NA
⑤0℃,101kPa,含有lmol硫原子的SO2与SO3的混合物,其体积小于22.4L
⑥常温常压下,17g甲基(-14CH3)所含的中子数为9NA
A. 1 B. 2 C. 3 D. 4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。据此,下列说法正确的是

A.该硫酸的物质的量浓度为9.2mol·L-1
B.该硫酸与等体积的水混合所得溶液的质量分数小于49%
C.配制200mL4.6mol·L-1的稀硫酸需取该硫酸50.0mL
D.该硫酸50.0mL与足量的铜反应可得到标准状况下SO2气体10.304L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,下列叙述错误的是

A. T的氧化物能与碱反应
B. 元素的非金属性:Q强于W
C. W的单质共热时,能与其最高价氧化物的水化物浓溶液反应
D. 原子序数比R多1的元素的一种氢化物能分解为它的另一种氢化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组欲利用氨气与CuO反应,研究氨气的性质并测其组成,设计了如下实验(夹持装置未画出)进行实验。请回答下列问题:

(1)仪器a的名称为____________;仪器b中可选择的试剂为(任意填一种)_____________。
(2)实验中,装置C中黑色CuO粉末全部转化为红色固体(已知Cu2O也为红色固体),量气管中有无色无味的气体。实验前称取黑色CuO 80g,实验后得到红色固体质量为68g。则红色固体成分的化学式为_______________。
(3)E装置中浓硫酸的作用是____________________________________。
(4)F中读取气体体积前,应对装置F进行的操作是:___________________,若无此操作,而F中左边液面低于右边液面,会导致读取的气体体积________ (填“偏大”或“偏小”或“无影响”);图中量气管可由________ (请选择字母填空:A.酸式滴定管,B.碱式滴定管)改装而成。
(5)要想测得氨气分子中氮、氢原子个数比,实验中应至少测量或读取哪些数据________。
A.B装置实验前后质量差mg; B.F装置实验前后液面差VL
C.D装置实验前后质量差mg; D.E装置实验前后质量差mg;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com