
【题目】向100mL FeI2溶液中逐渐通入C12,其中n(I2)、n(Fe3+)随通入n(C12)的变化如图所示,下列说法不正确的是
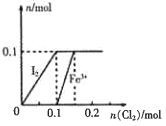
A. 氧化性强弱:I2<Fe3+
B. n(Cl2)=0.12mol时,溶液中的离子主要有Fe2+、Fe3+、Clˉ
C. 由图可知,该FeI2溶液的浓度为1mol· L-l
D. n(C12):n(FeI2)=1:2时,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-
【答案】D
【解析】A、根据图像可知,Cl2先氧化I-,后氧化Fe2+,还原性大小关系为I->Fe2+,所以氧化性大小关系为Fe3+>I2,A正确;B、根据图像可知,n(Cl2)=0.12mol时,I-已完全转化为I2,Fe2+部分被氧化,所以溶液中含有的离子主要为Fe2+、Fe3+、Clˉ,B正确;C、I-完全氧化需要消耗0.1molCl2,根据电子守恒可知I-的物质的量为0.2mol,FeI2的物质的量为0.1mol,所以FeI2溶液的浓度为1mol· L-l,C正确;D、n(C12):n(FeI2)=1:2时,设Cl2为1mol,提供2mol电子,I-的还原性大于Fe2+的还原性,Cl2先与I-发应且可以氧化2molI-,I-未完全氧化,所以对应的离子方程式为2I-+Cl2=2Cl-+I2,D错误。正确答案为D。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】铝热反应有广泛的用途,实验装置如下图所示。

(1)铝热反应是 __________________(填“吸热”或“放热”)反应,其能量变化可用下图中的 ___________________(填序号)表示。
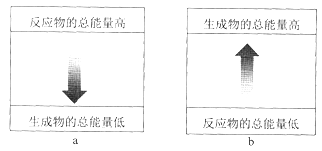
(2)该铝热反应的化学方程式是____________________________________。
(3)任写出铝热反应在实际生产中的一种用途____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一反应:2A+B2C,其中A、B、C均为气体,下图中的曲线是该反应在不同温度下的平衡曲线,x轴表示温度,y轴表示B的转化率,图中有a、b、c三点,如图所示,则下列描述正确的是( ) 
A.该反应是放热反应
B.b点时混合气体的平均摩尔质量不再变化
C.T1温度下a点表示若想达到平衡,可以采取增大压强的方法
D.c点可表示v(正)<v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. 氯气溶于水中:Cl2+H2O![]() H++Cl-+HC1O
H++Cl-+HC1O
B. 碳酸钙溶解于盐酸中 :CO32-+2H+=CO2↑ +H2O
C. 用苛性钠溶液吸收过量SO2:SO2+2OHˉ=SO32-+H2O
D. 硫酸与氢氧化钡溶液混合 :H++SO42-+Ba2++OHˉ =BaSO4↓ +H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等体积硫酸铁、硫酸镁、硫酸铵溶液分别与足量的氯化钡溶液反应。若生成的硫酸钡沉淀的质量相等,则三种硫酸盐溶液的物质的量浓度比为 ( )
A. 1︰3︰3 B. 3︰2︰1 C. 9︰6︰1 D. 6︰3︰2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸是当今世界最重要的化工产品之一。
I.硫酸的各种制法。
(1)早在1000多年前,我国就已采用加热胆矾(CuSO4· 5H2O)或绿矾(FeSO4·7H2O)的方法制取硫酸。FeSO4受热分解的化学方程式:2 FeSO4![]() Fe2O3+SO2↑ +SO3↑。
Fe2O3+SO2↑ +SO3↑。
① 将FeSO4受热产生的气体通入如下图装置中,以检验产生的气体中是否含有SO3和SO2。 能说明SO2存在的实验现象是_________。
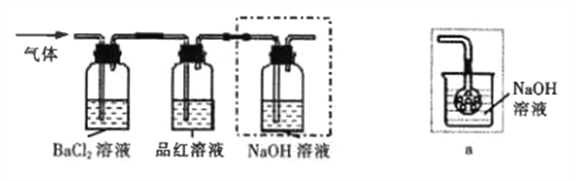
② 有同学提出虚线框内盛装NaOH溶液的装置可以换成上图右边的a装置,其中多孔玻璃球泡的作用是__________。
(2)目前工业上主要采用接触法制备硫酸,其中一步为:2SO2+O2![]() 2SO3。实验室模拟该过程常用下图装置进行实验。b装置中装有浓硫酸,写出b装置的作用__________(写出两点)。
2SO3。实验室模拟该过程常用下图装置进行实验。b装置中装有浓硫酸,写出b装置的作用__________(写出两点)。

Ⅱ.硫酸的性质。
(3)下图中甲试管内发生反应的化学方程式_________ ,该反应体现了浓硫酸的性质为______。

(4)当铜片与浓硫酸充分反应后,试管内并未出现蓝色溶液,而是看到白色固体,请写出检验白色固体的方法______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A.氨气通入醋酸溶液:CH3COOH+NH3=CH3COONH4
B.澄清的石灰水与盐酸反应:H++OH-=H2O
C.碳酸钡加入稀硫酸:BaCO3+2H+=Ba2++H2O+CO2↑
D.碳酸钙与盐酸反应:CO32-+2H+=H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧化镁固体在水中达到溶解平衡Mg(OH)2(s)═Mg2+(aq)+2OH﹣(aq)时,为使Mg(OH)2固体的量减少,可加入少量的( )
A.NaOH
B.NH4Cl
C.MgSO4
D.NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知钒的化合物在水溶液中存在多种离子形式:V2+(紫色)、V3+(绿色)、VO2+(蓝色)、VO2+(黄色)、VO43-(无色)、V5O143-(红棕色)等。
(1)如果向酸性的VSO4溶液中滴加高锰酸钾溶液,溶液出现的颜色变化是:紫色→绿色(I)→蓝色→绿色(Ⅱ)→黄色。则出现绿色(I)时发生反应的离子方程式是_________________________。
(2)向酸性(VO2)2SO4溶液中加入NaOH溶液调节pH,随着NaOH溶液的加入,溶液先出现红棕色,继续加入NaOH溶液,最终变为无色。写出(VO2)2SO4生成红棕色溶液,红棕色溶液变为无色溶液时发生反应的离子方程式:___________________________________________________________。
(3)向VO2+的溶液中加入氨水可以得到NH4VO3(微溶于水);NH4VO3受热最终会分解生成钒的氧化物。
①室温下,NH4VO3在水中的Ksp曲线如图Ⅰ所示,则其值为________。
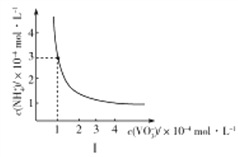
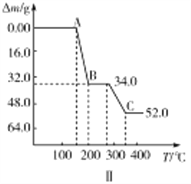
②热重分析可探究化学变化的历程,某研究小组取234gNH4VO3进行探究,焙烧过程中固体质量的减小量随温度的变化曲线如图Ⅱ所示,则B的化学式是__________,C的化学式是__________。
(4)已知2VO2++H2C2O4+2H+=2VO2++2CO2↑+2H2O。用硫酸酸化的H2C2O4溶液测定(VO2)2SO4溶液中钒含量的步骤为:取10.0mL0.1mol·L-1H2C2O4溶液于锥形瓶中,将待测液盛放在滴定管中;滴定到终点时,消耗待测液的体积为10.0mL.
①是否需要加入指示剂?________________。
②(VO2)2SO4溶液中钒的含量为________g·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com