
| A. | 乙醇易溶于水,难溶于有机溶剂 | |
| B. | 苯的分子结构中含有碳碳双键 | |
| C. | 乙烯通入酸性KMn04溶液中,紫色褪去 | |
| D. | 苯的硝化、乙烯使高锰酸钾酸性溶液褪色的反应都属于取代反应 |
分析 A、羟基是亲水基;
B、苯不是单双键交替的结构;
C、碳碳双键能被高锰酸钾氧化;
D、乙烯中碳碳双键能被高锰酸钾氧化.
解答 解:A、羟基是亲水基,故乙醇能和水以任意比互溶,而有机溶剂之间大多数可以互溶,故乙醇也易溶于有机溶剂,故A错误;
B、苯不是单双键交替的结构,故苯中无碳碳双键,故B错误;
C、碳碳双键能被高锰酸钾氧化,从而高锰酸钾被还原,故紫色退去,故C正确;
D、苯的硝化是取代反应,而乙烯能使高锰酸钾溶于褪色是由于乙烯中碳碳双键能被高锰酸钾氧化,从而高锰酸钾被还原,导致紫色退去,是氧化反应,故D错误.
故选C.
点评 本题考查了常见有机物的物理性质和化学性质,应注意常见反应的类型,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 1 mol CO2中含有原子数NA | |
| B. | 1mol/L的硫酸钠溶液中,所含Na+数为2NA | |
| C. | 标准状况下,11.2 L水所含分子数为0.5 NA | |
| D. | 1 mol Fe和足量盐酸完全反应失去的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaF=NaCN | B. | NaF>NaCN | C. | NaF<NaCN | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
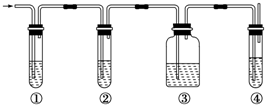
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④ | B. | ①④ | C. | ②③ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
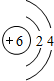
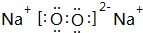 ;存在的化学键类型有离子键、共价键,其与甲反应的化学方程式是2Na2O2+2CO2=2Na2CO3+O2;
;存在的化学键类型有离子键、共价键,其与甲反应的化学方程式是2Na2O2+2CO2=2Na2CO3+O2;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com