
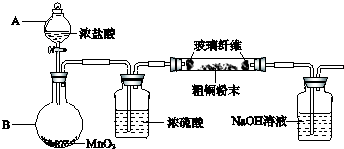
 已知:MnO2+4HCl(浓)
已知:MnO2+4HCl(浓)| △ |


 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:阅读理解
 已知KMnO4、MnO2在酸性条件下均能将草酸钠(Na2C2O4)氧化:
已知KMnO4、MnO2在酸性条件下均能将草酸钠(Na2C2O4)氧化:查看答案和解析>>
科目:高中化学 来源: 题型:
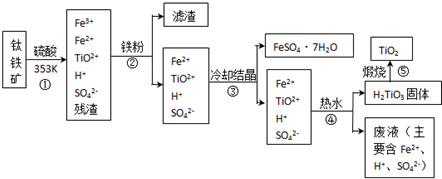
查看答案和解析>>
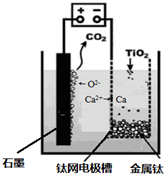
科目:高中化学 来源: 题型:

| ||
| ||
 CuCl42-(aq)+4H2O(l)
CuCl42-(aq)+4H2O(l)c(Cu
| ||
c[Cu
|
c(Cu
| ||
c[Cu
|
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
| ||
| 实验步骤 | 实验现象 | 用化学用语解释 |
| 将少量气体通入淀粉KI溶液 | 溶液最初变成 蓝 蓝 色 |
Cl2+2I-=I2+2Cl- Cl2+2I-=I2+2Cl- (用离子方程式表示) |
| 继续通入气体 | 溶液逐渐变成无色 | 5Cl2+I2+6H2O=2HIO3+10HCl 5Cl2+I2+6H2O=2HIO3+10HCl (用化学方程式表示) |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| ||
| ||
| 实验步骤 | 预期现象和结论 |
| 步骤l:取c中的少量固体样品于试管中,滴加足量蒸馏 水至同体溶解,然后将所得溶液分别置于a、b试管中. |
无明显现象 无明显现象 |
| 步骤2: 向A试管中滴加适量BaCl2溶液 向A试管中滴加适量BaCl2溶液 |
a.若无明显现象,证明固体中不含Na2CO3 b.若溶液变浑浊,证明固体中含Na2CO3 a.若无明显现象,证明固体中不含Na2CO3 b.若溶液变浑浊,证明固体中含Na2CO3 |
| 步骤3: 向B试管中滴加过量的稀硝酸,再滴加AgNO3溶液 向B试管中滴加过量的稀硝酸,再滴加AgNO3溶液 |
若溶液变浑浊,证明固体中含有NaCl 若溶液变浑浊,证明固体中含有NaCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com