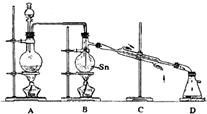
解:利用质量守恒定律和写出化学方程式,应为SnO
2+2C

Sn+2CO;电解精炼可得纯锡,精炼时的阴极发生还原反应生成Sn,电解精炼可得纯锡,精炼时的阴极 Sn
2++2e
-=Sn.故答案为:SnO
2+2C

Sn+2CO;Sn
2++2e
-=Sn;
(1)A为实验室制备氯气的反应,化学方程式为:MnO
2+4HCl(浓)

MnCl
2+Cl
2↑+2H
2O故答案为:MnO
2+4HCl(浓)

MnCl
2+Cl
2↑+2H
2;
(2)该反应放热,停止加热B装置,可依靠反应放出的热量维持Sn的熔化;故答案为:B;依靠反应放出的热量维持Sn的熔化;
(3)反应需控制在一定温度范围之内,需要温度计;根据题意知SnCl
4遇潮湿空气便发生水解反应,生成物应干燥,在装置D后应连接一个装有碱石灰的干燥管可达到目的,故答案为:缺少温度计;装置D后应连接一个装有碱石灰的干燥管;
(4)A制得的氯气没有除杂和干燥,会导致SnCl
4水解,不利于SnCl
4制备,则在A、B之间加除杂和干燥装置,故答案为:

.
分析:根据反应物和生成物,利用质量守恒定律和写出化学方程式,应为SnO
2+2C

Sn+2CO;电解精炼可得纯锡,精炼时的阴极发生还原反应生成Sn,电解精炼可得纯锡,精炼时的阴极 Sn
2++2e
-=Sn.
(1)A为实验室制备氯气的反应,化学方程式为:MnO
2+4HCl(浓)

MnCl
2+Cl
2↑+2H
2O;
(2)根据题意,该反应放热,停止加热B装置,可依靠反应放出的热量维持Sn的熔化;
(3)反应需控制在231℃以上,需要温度计;SnCl
4遇潮湿空气便发生水解反应,生成物应干燥;
(4)A制得的氯气没有除杂和干燥,会导致SnCl
4水解.
点评:本题考查较为综合,涉及到物质的制备、电解、除杂等问题实验方案的设计和评价.

 SnCl4的制备需分两步进行,第一步是金属Sn的制备,第二步由Sn和Cl2反应生成SnCl4.
SnCl4的制备需分两步进行,第一步是金属Sn的制备,第二步由Sn和Cl2反应生成SnCl4.
 Sn+2CO;电解精炼可得纯锡,精炼时的阴极发生还原反应生成Sn,电解精炼可得纯锡,精炼时的阴极 Sn2++2e-=Sn.故答案为:SnO2+2C
Sn+2CO;电解精炼可得纯锡,精炼时的阴极发生还原反应生成Sn,电解精炼可得纯锡,精炼时的阴极 Sn2++2e-=Sn.故答案为:SnO2+2C Sn+2CO;Sn2++2e-=Sn;
Sn+2CO;Sn2++2e-=Sn; MnCl2+Cl2↑+2H2O故答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O故答案为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2;
MnCl2+Cl2↑+2H2; .
. Sn+2CO;电解精炼可得纯锡,精炼时的阴极发生还原反应生成Sn,电解精炼可得纯锡,精炼时的阴极 Sn2++2e-=Sn.
Sn+2CO;电解精炼可得纯锡,精炼时的阴极发生还原反应生成Sn,电解精炼可得纯锡,精炼时的阴极 Sn2++2e-=Sn. MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;


 SnCl4的制备需分两步进行,第一步是金属Sn的制备,第二步由Sn和Cl2反应生成SnCl4.
SnCl4的制备需分两步进行,第一步是金属Sn的制备,第二步由Sn和Cl2反应生成SnCl4.