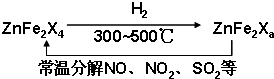W、X、Y、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Y、Z是非金属元素.
(1)W、X各自的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为______.
(2)W与Y可形成化合物W2Y,该化合物的电子式为______.
(3)X的硝酸盐水溶液显______性,用离子方程式解释原因:______.
(4)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为______.
(5)比较Y、Z气态氢化物的稳定性:______>______(用分子式表示).
(6)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是______>______>______>______.
(7)Z的最高价氧化物为无色液体,0.25mol该物质与一定量水混合得到一种稀溶液,并放出Q kJ的热量.写出该反应的热化学方程式:______.
【答案】
分析:(1)金属元素的最高价氧化物对应的水化物是碱,两者能反应生成盐和水,应为强碱和两性氢氧化物;
(2)先根据题目信息推出W
2Y的化学式,再写出其电子式;
(3)根据Al(NO
3)
3为强酸弱碱盐能发生水解反应判断酸碱性,
(4)根据S低价氧化物为SO
2,Z的单质只能为Cl
2,两者发生反应;
(5)根据元素的非金属性越强,氢化物的稳定性越强;
(6)根据核外电子排布相同的离子,原子序数小的半径反而大;最外层电子数相同时,电子层数越多,半径越大;
(7)根据Cl的最高价氧化物为Cl
2O
7,与水反应的化学方程式为Cl
2O
7+H
2O═2HClO
4,然后写出热化学方程式;
解答:解:(1)因两种金属的最高价氧化物对应的水化物能反应生成盐和水,应为强碱和两性氢氧化物,
因此应为NaOH和Al(OH)
3,其反应的离子方程式为Al(OH)
3+OH
-═AlO
2-+2H
2O;
(2)因W
2Y及原子序数Y大于钠,又为短周期元素,可知W
2Y为Na
2S,
(3)因Al(NO
3)
3为强酸弱碱盐,能发生水解反应Al
3++3H
2O?Al(OH)
3+3H
+,水解后溶液显酸性;
(4)因S低价氧化物为SO
2,Z只能为Cl,则SO
2与Cl
2在水中反应生成HCl和H
2SO
4.
(5)因Cl的非金属性强于S,所以HCl的稳定性大于H
2S.
(6)因核外电子排布相同的离子,原子序数小的半径反而大,可得r(Al
3+)<r(Na
+),r(S
2-)>r(Cl
-);最外层电子数相同时,电子层数越多,半径越大,可得r(S
2-)>r(Cl
-)>r(Na
+)>r(Al
3+);
(7)因Cl的最高价氧化物为Cl
2O
7,与水反应的化学方程式为Cl
2O
7+H
2O═2HClO
4.0.25molCl
2O
7与一定量水混合得到一种稀溶液,并放出Q kJ的热量,所以Cl
2O
7(1)+H
2O(1)═2HClO
4(aq)△H=-4Q kJ/mol;
故答案为:(1)Al(OH)
3+OH
-═AlO
2-+2H
2O
(2)
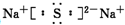
(3)酸 Al
3++3H
2O?Al(OH)
3+3H
+(4)SO
2+Cl
2+2H
2O═H
2SO
4+2HCl
(5)HCl H
2S
(6)S
2- Cl
- Na
+ Al
3+ (7)Cl
2O
7(1)+H
2O(1)═2HClO
4(aq)△H=-4Q kJ/mol.
点评:本题涉及到的知识点较多,试题的难度中等,只要掌握基础知识并加以分析即可完成.

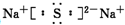


 Q、W、X、Y、Z是原子序数逐渐增大的短周期元素.已知Q在所有原子中的原子半径最小,W是形成化合物种类最多的元素,Y的最外层电子数是内层电子数的3倍,Y和Z能形成原子个数比为1:1和1:2的两种离子化合物.
Q、W、X、Y、Z是原子序数逐渐增大的短周期元素.已知Q在所有原子中的原子半径最小,W是形成化合物种类最多的元素,Y的最外层电子数是内层电子数的3倍,Y和Z能形成原子个数比为1:1和1:2的两种离子化合物.