
A��B��C��D��EΪԭ��������������Ķ�����Ԫ�ء�A��C����ͬһ���壬C��D��E����ͬһ���ڣ�Eԭ�ӵ�������������A��B��Cԭ������������֮�ͣ�D�ǵؿ��к�����ߵĽ���Ԫ�أ�A��B��ɵij����������ʹʪ��ĺ�ɫʯ����ֽ������E�ĵ������Ӧ������B�ĵ��ʣ�ͬʱ��������ˮ��Һ�������ԵĻ������Һͱ�(�÷�Ӧ����������ֻ��һ��)��25��ʱ0.1 mol/L������ҺpH>l��D�ĵ��ʼ�����CԪ������������ˮ�������Һ��Ӧ�����ζ���Ҳ�������ˮ��Һ��Ӧ�����Ρ�
��ش��������⣺
��1���Ļ�ѧʽΪ ��B���ʵĵ���ʽΪ ��
��2��DԪ�ص������� ��
��3��д������Һ��ͨ�����������̼ʱ�����ӷ���ʽ
��4����ҵ������A��B�ĵ��ʺϳɼ�(BA3)��B2 (g)+3A2 (g)  2BA3 (g) ��H<0����һ���¶��£���2 L�ܱ������У�2 mol����B2��1.6mol����A2��ַ�Ӧ��ﵽƽ�⣬���BA3�����ʵ���Ũ��Ϊ0.4 mol/L��������¶��µ�ƽ�ⳣ��K=______________��
2BA3 (g) ��H<0����һ���¶��£���2 L�ܱ������У�2 mol����B2��1.6mol����A2��ַ�Ӧ��ﵽƽ�⣬���BA3�����ʵ���Ũ��Ϊ0.4 mol/L��������¶��µ�ƽ�ⳣ��K=______________��
��5��E�ĵ������Ӧ���ɵ��Һͱ������ʵ���֮��Ϊ2:4����Ӧ�б������������뱻��ԭ�����ʵ����ʵ���֮��Ϊ ��
 ������ʱͬ����ϰ��ϵ�д�
������ʱͬ����ϰ��ϵ�д� ѧҵ����һ��һ��ϵ�д�
ѧҵ����һ��һ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ��㶫ʡ������һ�����ѧУ��һ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
����������ȷ���ǣ� ��
A��HClO�����ᣬ����NaClO���������
B�����ˮ����μ�����������FeCl3��Һ�����Ƶ�Fe(OH)3����
C�����ݷ�ɢ�����ӵ�ֱ����С����ɢϵ�ɷ�Ϊ��Һ����Һ�ͽ��壬��Һ�ķ�ɢ�����Ӵ�С������Һ�뽺��֮��
D����ѪҺ����ԭ���뽺���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�����ʡ��һ��ѧ��12���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
ʵ����������һ�ֽ����������ӣ�������ˮ����������ӣ��Ļ����Һ�����ڻ��Һ���������ӵ����ʵ���Ũ�Ⱦ�Ϊ0.5 mol��L��1�������ĸ�ѡ�����ܴﵽ��Ŀ�ĵ���( )
A��Fe2����Na����NO ��Cl�� B��Mg2����NH
��Cl�� B��Mg2����NH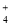 ��SO
��SO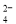 ��NO
��NO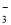
C��H����K����Cl����CH3COO�� D��K����Mg2����CO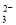 ��OH��
��OH��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�츣��ʡ������ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
����ɫ��Һ�м������Ba2����Ag����ͬʱ�ֲ�������Ժ�ǿ��ijѧ����Ҫ��������Һ���Ƿ�������ڣ���Cu2����Fe3����Cl����NO3����S2����CO32����NH4����Mg2����Al3����[Al��OH)]4�����ӡ���ʵ����Щ��������һ���ֲ����ټ������ܼ��Է�����Ϊ���ؼ�������������()
A���ۢݢޢߢ�B���٢ڢݢޢ��C���ۢܢߢ��D���٢ڢۢݢޢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016��㶫ʡ��У�����������ѧ�ڵڶ����������ۻ�ѧ�Ծ��������棩 ���ͣ�ʵ����
ʵ�������Ҵ���Ũ������廯�Ʒ�Ӧ���Ʊ������飬�䷴Ӧԭ����ʵ���װ������(��Ӧ��Ҫ���ȣ�ͼ��ʡȥ�˼���װ��)��H2SO4(Ũ)��NaBr  NaHSO4��HBr����CH3CH2OH��HBr
NaHSO4��HBr����CH3CH2OH��HBr CH3CH2Br��H2O���й����ݼ��±���
CH3CH2Br��H2O���й����ݼ��±���
�Ҵ� | ������ | �� | |
״̬ | ��ɫҺ�� | ��ɫҺ�� | ���ɫҺ�� |
�ܶ�/(g��cm��3) | 0.79 | 1.44 | 3.1 |
�е�/�� | 78.5 | 38.4 | 59 |
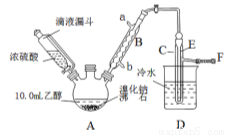
��1��Aװ�õ������� ��
��2��ʵ�����õ�Һ©�������Һ©�����ŵ�Ϊ ��
��3����A�����¶ȹ���Ũ�����Ũ�ȹ�����ʹ�����ռ����Ĵֲ�Ʒ�ʳ�ɫ��ԭ���ǣ��з����˸���Ӧ��д���˷�Ӧ�Ļ�ѧ����ʽ ��
��4����A���ȵ�Ŀ���� ��F����Ƥ�ܵ���ϡNaOH��Һ����Ŀ����Ҫ�� ��
��5��ͼ��C�еĵ���E��ĩ������ˮ�����£���Ŀ���� ��
��6��Ϊ�˳�ȥ��Ʒ�е���Ҫ���ʣ����ѡ������__��ѡ����ţ���Һ��ϴ�����ôֲ�Ʒ
A���������� �� B���⻯�� �� C���������� �� D��̼������
��7���ֲ�Ʒ��������Һϴ�ӡ���Һ���پ�������ˮϴ�ӡ���Һ��Ȼ�������������ˮ����þ���壬����Ƭ�̺���ˣ��ٽ�������Һ���������ռ��������Լ10.0 g��
���������ᴿ������ÿ�η�Һʱ��Ʒ���ӷ�Һ©����_____________(�Ͽڻ��¿�)ȡ�á�
�ڴ��Ҵ��ĽǶȿ��ǣ���ʵ������������IJ�����______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�켪��ʡ������ѧ�ڵڶ���ģ�⻯ѧ�Ծ��������棩 ���ͣ������
��ͼ��һ����ѧ���̵�ʾ��ͼ��

��1��ͼ�м׳���OH-���� ��(�CH3OH����O2��)��
��2��д��ͨ��CH3OH�ĵ缫�ĵ缫��Ӧʽ�� ��
��3�����ҳ����缫�����μ�������ɫʯ����Һ���������ĵ缫Ϊ ��(�A����"B��)����д���˵缫�ķ�Ӧʽ��____ ��
��4���ҳ����ܷ�Ӧ�����ӷ���ʽ��____ ��
��5�����ҳ���B(Ag)������������5.4gʱ���ҳص�pH�� (����ʱ�ҳ�����Һ�����Ϊ500mL)����ʱ����ij�缫����1.60gij����������е�ij����Һ������ (�����)��
A�� MgSO4 B��CuSO4 C��AgNO3 D��AlCl3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�켪��ʡ�����и�����ѧ���ʼ컯ѧ�Ծ��������棩 ���ͣ������
���������ۡ�8•12���ش���ֱ�ը�¹ʣ���һ�����������ǶԻ�������Ĺ�ע��
��1��Ϊ�˼��ٿ�����SO2���ŷţ�����ȡ�Ĵ�ʩ�ǽ�úת��Ϊ�������ȼ�ϣ�
��֪��H2(g)+ O2(g)�TH2O(g)��H1=��241.8kJ•mol��1
O2(g)�TH2O(g)��H1=��241.8kJ•mol��1
C(s)+ O2(g)�TCO(g)��H2=��110.5kJ•mol��1
O2(g)�TCO(g)��H2=��110.5kJ•mol��1
��̿��ˮ������Ӧ����CO���Ȼ�ѧ����ʽΪ�� ��
��2������CaC2�������ơ������ص������ܹ���ˮ��Ӧ���ֺ��Ԯ���������˺ܶ����ѣ������ʵ���ң��㴦���������Ż�ķ����� ��
��3���¹ʷ�����ը����������ը������¥�ܱ��Լ����ӵȴ����ܵ������ص��軯����Ⱦ������NaCN�ķ����ǣ���NaClO�ڼ��������¸�NaCN��Ӧ�������������ʣ���д���÷�Ӧ�����ӷ�Ӧ����ʽ ��
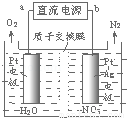
��4���绯ѧ���ⷨ����������ˮ�������ε���Ⱦ���绯ѧ����NO3-��ԭ����ͼ��ʾ����Դ����Ϊ (�a����b��)�����ܷ�ӦΪ4NO3��+4H+�T5O2��+2N2��+2H2O����������ӦʽΪ ��
��5�������ͷ�ˮ���ؽ���Ԫ�ظ��Ķ��ԣ��ɽ�Cr2O72��ת��ΪCr(OH)3������ȥ��
��֪�ڳ����£�Ksp[Fe(OH)2]=1��10��15��Ksp[Fe(OH)3]=1��10��38��Ksp[Cr(OH)3]=1��10��23��������Ũ����1��10��5mol/L����ʱ��Ϊ�������Ѿ���ȫ��������ش�
����ͬ�¶���Fe(OH)3���ܽ�� Cr(OH)3���ܽ��(���������������=��)
��Ũ��Ϊ0.1mol/L��Fe2+��10.0mol/L Cr3+ͬʱ���ɳ�����pH��Χ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�콭��ʡ������ѧ�ڵ������¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��T ��ʱ����a g NH3��ȫ����ˮ���õ�V mL��Һ���������Һ���ܶ�Ϊ�� g��cm��3�����ʵ���������Ϊw�����к�NH4+�����ʵ���Ϊb mol������������һ����ȷ����
A�����ʵ���������Ϊw��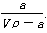 ��100%
��100%
B�����ʵ����ʵ���Ũ��c��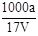 mol��L��1
mol��L��1
C����Һ��c(OH��)��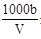 mol��L��1
mol��L��1
D��������Һ���ټ���VmLˮ��������Һ���ʵ�������������0.5w
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�긣��ʡ�߶���12���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
����ͼ���л����У�ͬһƽ����̼ԭ�������Ŀ��ͬһֱ���ϵ�̼ԭ�������Ŀ�ֱ�Ϊ

A��11��4 B��10��3 C��12��4 D��13��4
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com