
向含有CaCO3固体的溶液中滴加少许浓盐酸(忽略体积变化),下列数值变小的是( )
A.c(H+) B. c(Ca2+) C. c(CO32-) D. Ksp(CaCO3)
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2016-2017学年浙江省温州市十校联合体高二上期末化学试卷(解析版) 题型:实验题
某化学课外小组以海带为原料制取了少量碘水。现用四氯化碳从碘水中萃取碘并用分液漏斗分离这两种溶液,其实验操作可分为如下几步:
①检验分液漏斗活塞和上口玻璃塞是否漏液。
②把50 mL碘水和15 mL四氯化碳加入分液漏斗中,并盖好玻璃塞。
③倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正。
④把盛有溶液的分液漏斗放在铁架台的铁圈中。
⑤将漏斗上口的玻璃塞打开或使塞上的凹槽、小孔对准漏斗口上的小孔。
⑥静置,分层。
⑦旋开活塞,用烧杯接收溶液。
⑧从分液漏斗上口倒出上层水溶液。
回答下列问题:
(1)在上述实验过程中,不必要的玻璃仪器是____________。
A.烧杯 B.玻璃棒 C.胶头滴管 D.量筒
(2)步骤⑦的操作中最应注意的是:_______________________________,及时关闭旋塞。
(3)下列操作或说法正确的是______________。
A.分液漏斗使用前须检漏,方法是向漏斗中加水,观察水是否从漏斗口流出,若不流出,则不漏水
B.萃取后分液漏斗内观察到的现象是液体分二层,上层接近无色,下层紫红色
C.可以由苯代替四氯化碳,但不可以用乙醇
D.可以采用蒸馏的方法来进一步分离碘和四氯化碳
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市高一上期末化学卷(解析版) 题型:选择题
下列气体的制备和性质实验中,由现象得出的结论错误的是
选项 | 试剂 | 试纸 | 现象 | 结论 |
A | 浓氨水、生石灰 | 红色石蕊试纸 | 变蓝 | NH3为碱性气体 |
B | 浓盐酸、浓硫酸 | 紫色石蕊试纸 | 变红 | HCl为酸性气体 |
C | 浓盐酸、二氧化锰 | 淀粉碘化钾试液 | 变蓝 | Cl2具有氧化性 |
D | 亚硫酸钠、硫酸 | 品红试液 | 褪色 | SO2具有还原性 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省等名校高二上期末化学卷(解析版) 题型:填空题
一种甲醇燃料电池以稀硫酸为电解液,其中一个电极上加入甲醇(CH3OH),同时另一个电极通入空气:
(1)此电池的负极反应式是__________;
(2)正极电极反应式是___________;
(3)电解液中的H+向___________极移动。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省等名校高二上期末化学卷(解析版) 题型:选择题
在密闭容器中发生下列反应 aA(g)  cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.7倍,下列叙述正确的是( )
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.7倍,下列叙述正确的是( )
A.A的转化率变小 B.平衡向正反应方向移动
C.D的物质的量变多 D.a>c+d
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省乐山市高二上学期期末化学试卷(解析版) 题型:计算题
现有反应:CO(g)+ H2O(g)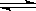 CO2(g)+ H2(g) △H﹤0,在850℃时,平衡常数K=1。现在850℃时,向2L的密闭容器中充入CO、H2O(g)各4mol,试回答下列问题(写出具体的计算过程):
CO2(g)+ H2(g) △H﹤0,在850℃时,平衡常数K=1。现在850℃时,向2L的密闭容器中充入CO、H2O(g)各4mol,试回答下列问题(写出具体的计算过程):
(1)达平衡时,CO转化率为多少?
(2)H2的体积分数为多少?
(3)若温度仍为850℃,初始时CO浓度为2mol/L,H2O(g)为6mol/L,则平衡时CO转化率为多少?
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省乐山市高二上学期期末化学试卷(解析版) 题型:选择题
下列关于平衡常数K的说法中,正确的是
A.在任何条件下,化学平衡常数是一个恒定值
B.改变反应物浓度或生成物浓度都会改变平衡常数K
C.平衡常数K只与温度有关,与反应浓度、压强无关
D.从平衡常数K的大小不能推断一个反应进行的程度
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省简阳市高二上学期期末化学试卷(解析版) 题型:填空题
今年入冬以来,简阳的雾霾较为严重,NO是引起原因之一。综合治理空气污染是环境化学当前主要研究的内容。
(1)汽车尾气中的NO(g)和CO(g)在一定温度和催化剂条件下可转化为N2(g)和CO2(g)得到净化。
①已知 2NO(g)+2CO(g) N2(g)+2CO2(g)反应能自发进行,则该为___________反应(填“吸热”或“放热”)。
N2(g)+2CO2(g)反应能自发进行,则该为___________反应(填“吸热”或“放热”)。
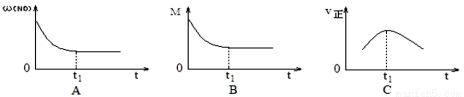
②上述反应在绝热、恒容密闭容器中进行,并在 t1时可达到平衡(图中 ω、M、v 正分别表示质量分数、混合气体平均相对分子质量和正反应速率),则下列示意图中符合题意的是___________(填选项序号)。
(2)在25℃、101kPa下,将2 mol NO、2.4 mol CO通入固定容积为2 L的密闭容器中,反应过程中部分物质的浓度变化如图所示。

①NO的转化率为 ,0~15min 内,v(NO) = 。
②20min 时若改变反应条件,导致CO浓度下降,则改变的条件可能是 (填选项序号)。
a.升高温度 b.增加CO的量 c.降低温度 d.扩大容器体积
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省广安市高一上学期期末化学试卷(解析版) 题型:选择题
设阿伏加德罗常数为NA,下列说法正确的是
A.常温常压下,22.4LH2O中含有的氢原子数为2NA
B.17gNH3与18 g H2O所含有电子数均为10NA
C.2.7 g Al与足量的NaOH溶液反应,生成H2的分子数为0.1NA
D.1 mol HCl气体中的分子数与2L 0.5 mol/L盐酸中的溶质粒子数相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com