
在①Al ②Al2O3 ③Al(OH)3 ④NaHCO3四种物质中,既能与硫酸反应又能和氢氧化钠反应的化合物是
A. ②③④ B. ①②③④ C. ①③④ D. ①②④
科目:高中化学 来源:2017届江苏省联盟大联考高三2月联考化学试卷(解析版) 题型:选择题
25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是
A. 0.1mol/L的Na2CO3溶液中:c(HCO3-)=2c(HCO3-)+c(H+)- c(OH-)
B. 物质的量浓度之比为1:2的NaClO、NaHCO3混合溶液中: c(HClO)+c(ClO-)=2c(HCO3-)+2c(CO32-)+2c(H2CO3)
C. 向3.0L0.1mol/LNaOH溶液中缓慢通入CO2至溶液增重8.8g时,溶液中: c(Na+)>c(CO32-)> c(HCO3-) >c(OH-)>c(H+)
D. 等物质的量的CH3COOH、CH3COONa混合溶液PH=4.75中:c(CH3COO-)+ c(OH-)>c(CH3COOH)+ c(H+)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省南昌市高二上学期期末考试化学试卷(解析版) 题型:简答题
某种工业废水中含有一定量的Cr2O72-和CrO42-,它们易被人体吸收积累而导致肝癌。污水处理厂常用还原沉淀法处理含铬废水,其流程如下:
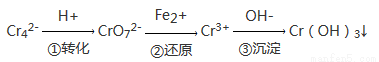
(1)已知第①步存在平衡:2CrO42-(黄色)+2H+ Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
① Cr2O72-中Cr的化合价是_______________。
② 常温下,若平衡体系的pH=10,则溶液显_________________色。
(2)第②步发生反应的离子方程式为__________,还原1 mol Cr2O72-离子,需要__________mol的FeSO4·7H2O;
(3)常温下,Cr(OH)3的溶度积Ksp=10-32,要使c(Cr3+)降至10-5 mol/L,溶液的pH应调至______。
查看答案和解析>>
科目:高中化学 来源:河北省2016-2017学年高一下学期开学考试化学试卷 题型:计算题
将0.1molMg 、Al混合物溶于100mL3mol/LHCl中,再滴加1mol/LNaOH 溶液,在滴加NaOH溶液的过程中,沉淀的质量m随NaOH溶液体积V变化如图所示:

(1)写出A→B段反应的离子方程式_____________。
(2)A点沉淀的总物质的量n= _________________。
(3)欲使Mg2+ 、Al3+刚好沉淀完全,则加入NaOH溶液的体积为多少___________mL?(写出计算过程,下同)
(4)若V1=60mL,则混合物中Mg的物质的量为多少___________? V3点所加NaOH溶液的体积为多少___________mL?
查看答案和解析>>
科目:高中化学 来源:河北省2016-2017学年高一下学期开学考试化学试卷 题型:选择题
气体的体积主要由气体以下哪些因素决定:
①分子的直径 ②分子的相对分子质量
③分子间的平均距离 ④气体的物质的量
A. ①② B. ②③ C. ①③ D. ③④
查看答案和解析>>
科目:高中化学 来源:河北省2016-2017学年高一下学期开学考试化学试卷 题型:选择题
在含有Fe3+、Fe2+、Al3+、Cl﹣的溶液中,加入过量的Na2O2并微热,充分反应后,再加入过量的稀盐酸,完全反应后,下列离子的数目没有明显变化的是
A. Al3+ B. Fe2+ C. Fe3+ D. Cl﹣
查看答案和解析>>
科目:高中化学 来源:2016-2017学年福建省高一下学期开学考试化学试卷(解析版) 题型:推断题
已知A是生产生活中用量最大的金属,B为淡黄色粉末。在常温下C为无色液体,E、G、H、I、J为气体,其中H为黄绿色,其它为无色.J能使湿润的红色石蕊试纸变蓝(图中部分产物已略去)。

请填写下列空白
(1)写出化学式:M______,K______。
(2)写出①的化学方程式_________________________________;写出③的离子方程式_________________________________。
(3)反应④属于下列何种反应类型______(填字母序号)。
A.化合反应 B.氧化还原反应 C.离子反应 D.置换反应
(4)若要确定③反应后所得溶液中含有M物质,所选试剂为______(填序号)。
A.KSCN溶液和氯水 B.铁粉和KSCN C.浓氨水 D.酸性高锰酸钾溶液
(5)常温下,H与过量的J反应产生浓厚的白烟,另一生成物是空气的主要成分之一,请写出该反应的化学方程式_________________________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年福建省高一下学期开学考试化学试卷(解析版) 题型:选择题
下列各组混合物中,能用分液漏斗进行分离的是
A. 水和CCl4 B. 溴和CCl4 C. 酒精和水 D. 汽油和植物油
查看答案和解析>>
科目:高中化学 来源:2017届广西省高三2月月考理综化学试卷(解析版) 题型:填空题
磷和其化合物在科研及生产中均有着重要的作用。
(1)红磷P(s)和Cl2(g)发生反应生成PCl3(g)PCl5(g),反应过程如下:
2P(s) + 3Cl2(g) = 2PCl3(g) △H=-612kJ/mol
2P(s) + 5Cl2(g) = 2PCl5(g) △H=-798kJ/mol
气态 PCl5生成气态PCl3和Cl2的热化学方程式为________。
(2)一定温度下,在三个恒容体积均为2.0L的容器中发生反应:PCl5(g) PCl3(g)+Cl2(g)
PCl3(g)+Cl2(g)
编号 | 温度(℃) | 起始/mol | 平衡/mol | 达到平衡所需时间/s | |
PCl5(g) | PCl3(g) | Cl2(g) | |||
I | 320 | 0.40 | 0.10 | 0.10 | t1 |
II | 320 | 0.80 | t2 | ||
III | 410 | 0.40 | 0.15 | 0.15 | t3 |
①平衡常数K:溶液II____溶液III(填“>”或“=”或“<”)
②反应达到平衡时,PCl3的转化率:容器II_____容器I(填“>”或“=”或“<”)
(3)亚磷酸(H2PO5)与足量的NaOH溶液反应生成Na2HPO3。电解Na2HPO3溶液也可得到亚鱗酸,装置示意图如图:
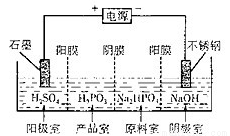
阴极的电极反应式为_______;产品室中反应的离子方程式为__________。
(4)一定温度下,Ksp[Mg3(PO4)2]=6.0×10-29,Ksp[Ca3(PO4)2]=6.0×10-26向浓度均为0.20 mol·L-1的MgCl2和CaCl2混合溶液中逐滴加入Na3PO3,先生成________沉淀(填化学式);当测得溶液其中一种金属阳离子沉淀完全(浓度小于105mol/L)时,溶液中的另一种金属阳离子的物质的量浓度c= ______mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com