
下列说法不正确的是
A. 利用浓硫酸的吸水性,干燥氢气
B. 碳酸氢钠溶液呈碱性,可用于治疗胃酸过多
C. 氯化铝是电解质,电解熔融的氯化铝制备金属铝
D. 镁在空气中燃烧时发出耀眼的白光,可用于制造信号弹
科目:高中化学 来源:2016-2017学年浙江省台州市高二上学期期末质量评估考试化学试卷(解析版) 题型:选择题
香港食环署食物安全中心日前宣布,两个大闸蟹养殖场样本,被验出二噁英样多氯联苯含量超标。2,4,7,8-四氯二苯并呋喃是其中的一种,结构简式如图,下列有关该物质的说法正确的是( )

A. 能发生氧化反应 B. 一溴取代物只有一种 C. 属于氯代芳香烃 D. 易溶于水
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省宿州市高一上学期期末教学质量检测(a卷)化学试卷(解析版) 题型:选择题
在下图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶。则a和b分别是

A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源:2017届江苏省联盟大联考高三2月联考化学试卷(解析版) 题型:选择题
一定条件下,在三个容积均为2L的恒容密闭容器中发生反应:H2(g)+CO2(g)  HCOOH(g)。下列说法正确的是
HCOOH(g)。下列说法正确的是
容器编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/mol | |
H2 | CO2 | HCOOH | |||
Ⅰ | 150 | 0.4 | 0.4 | 0.2 | 2 |
Ⅱ | 150 | 0.8 | 0.8 | t1 | |
Ⅲ | 0.4 | 0.4 | 0.16 | t2 | |
A. 反应达到平衡时,容器Ⅰ中的平均反应速率为v(H2)=0.1mol/(L·min)
B. 反应达到平衡时,容器Ⅱ所需时间t2<2min
C. 若只改变一个反应条件,容器Ⅲ可能是加入了合适的催化剂
D. 起始时,向容器Ⅱ中充入0.45mol H2、0.20mol CO2 和0.18molHCOOH,则反应向正反应方向进行
查看答案和解析>>
科目:高中化学 来源:2017届江苏省联盟大联考高三2月联考化学试卷(解析版) 题型:选择题
在给定条件下,下列选项中物质间的转化均能一步实现的是
A. S SO2
SO2 H2SO4 B. Al3+
H2SO4 B. Al3+ AlO2-
AlO2- Al(OH)3
Al(OH)3
C. NaCl(aq) Na
Na Na2O2 D. Fe
Na2O2 D. Fe FeSO4(aq)
FeSO4(aq)  Fe(OH)2
Fe(OH)2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省六校协作体高一下学期期初化学试卷(解析版) 题型:简答题
Ⅰ. 有一瓶澄清溶液,可能含有NH4+、K+、Mg2+、Ba2+、Al3+、Fe3+、SO42-、CO32-、NO3-、Cl―、I―现进行如下实验:
①测知溶液显强酸性;②取样加少量CCl4和数滴新制氯水,CCl4层为紫红色;
③另取样滴加稀NaOH溶液,使溶液变为碱性,此过程中均无沉淀生成;
④取少量上述碱性溶液,加Na2CO3溶液出现白色沉淀;
⑤将实验③中的碱性溶液加热,有气体放出,该气体能使湿红色石蕊试纸变蓝。
请回答:(1)原溶液中肯定存在的离子是____________________
(2)不能确定是否存在的离子是____________________
Ⅱ.氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式: NO3-+ 4H++3e-→NO↑+ 2H2O
其中KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式______________________________。
(2)反应中硝酸体现了________________、_______________性质。
(3)反应中若产生0.2mol气体,则转移电子的数目是_____________。
(4)若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是_______
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省六校协作体高一下学期期初化学试卷(解析版) 题型:选择题
化学实验中常将溶液或试剂进行酸化,下列酸化处理的措施正确的是
A. 定性检验SO ,将BaCl2溶液用HNO3酸化
,将BaCl2溶液用HNO3酸化
B. 为提高高锰酸钾溶液的氧化能力,用盐酸将高锰酸钾溶液酸化
C. 检验溶液中是否含有Fe2+时,用硝酸酸化
D. 检验溶液中是否含有SO 时,在无其他阳离子干扰的条件下,先用盐酸酸化,所得溶液再加BaCl2溶液
时,在无其他阳离子干扰的条件下,先用盐酸酸化,所得溶液再加BaCl2溶液
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省南昌市高二上学期期末考试化学试卷(解析版) 题型:计算题
如图所示的装置中,若通入直流电5 min时,铜电极质量增加2.16 g。
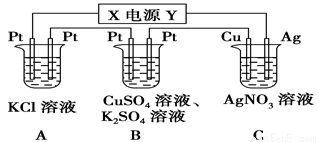
(1)电源电极X的名称为________。
(2)pH变化:A_______,B_______,C_______。(填“增大”“减小”或“不变”)
(3)通电5 min后,B中共收集224 mL气体(标准状况),溶液体积为200 mL,则通电前CuSO4溶液的物质的量浓度为______________(设电解前后溶液体积无变化)。
(4)若A中KCl溶液的体积也是200 mL,电解后,溶液的pH为_______(设电解前后溶液体积无变化)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年福建省高一下学期开学考试化学试卷(解析版) 题型:简答题
现有含有少量NaCl、 Na2SO4、Na2CO3等杂质的NaNO3溶液,选择适当的试剂除去杂质,得到纯净的NaNO3固体,实验流程如下图所示。

(1)沉淀A的主要成分是_____________、______________(填化学式)。
(2)①②③中均进行的分离操作是_______________。
(3)溶液3经过处理可以得到NaNO3固体,溶液3中肯定含有的杂质是__________,为了除去杂质,可向溶液3中加入适量的______________。
(4)实验探究小组在实验中需要用到456 mL1 mol•L-1的HNO3溶液,但是在实验室中只发现一瓶8 mol•L-1的HNO3溶液,该小组用8mol•L-1的HNO3溶液配制所需溶液。
①实验中所需的玻璃仪器包括_________、________mL量筒、烧杯、__________、胶头滴管等。
②该实验中需要量取8mol•L-1的HNO3溶液________mL。
③下列实验操作中导致配制的溶液浓度偏高的是_____________。
A.取8mol•L-1的HNO3溶液溶液时仰视刻度线
B.量取用的量筒水洗后未进行任何操作
C. 8mol•L-1的HNO3溶液从量筒转移至烧杯后用水洗涤量筒并全部转移至烧杯
D.定容时仰视刻度线
E.定容后,将容量瓶振荡摇匀后,发现液面低于刻度线,未进行任何操作
(5)某同学转移溶液的操作如图所示,该同学操作中的错误是______________________________________。容量瓶的刻度线标在比较细的瓶颈之上的原因是___________。

A.为了美观 B.为了统一标准 C.为了提高准确度 D.方便刻画
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com