


科目:高中化学 来源: 题型:
 (R1、R2、R3代表烃基)
(R1、R2、R3代表烃基)

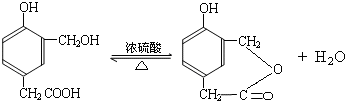

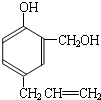

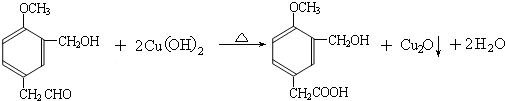

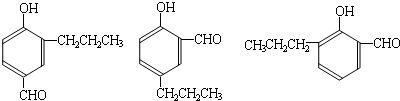

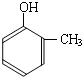 到的合成
到的合成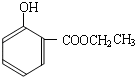 路线(用合成路线流程图表示,并注明反应条件).
路线(用合成路线流程图表示,并注明反应条件).| 浓H2SO4 |
| 170℃ |
| 高温、高压 |
| 催化剂 |

查看答案和解析>>
科目:高中化学 来源: 题型:
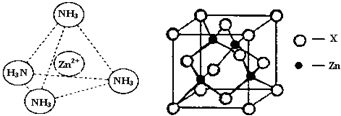
查看答案和解析>>
科目:高中化学 来源: 题型:
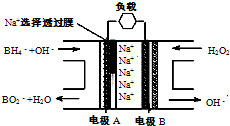 (2010?启东市模拟)直接NaBH4/H2O2燃料电池(DBFC)的结构如图,“负极材料采用Pt/C,正极材料采用MnO2”,有关该电池的说法正确的是
(2010?启东市模拟)直接NaBH4/H2O2燃料电池(DBFC)的结构如图,“负极材料采用Pt/C,正极材料采用MnO2”,有关该电池的说法正确的是查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| 滴加溶液A的体积/mL | 10.0 | 20.0 | 30.0 |
| 生成气体的体积/mL(标准状况) | 89.6 | 179.2 | 224 |
| 16n(H2O2) |
| m(样品) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com