
����Ŀ�������£���25 mL 0.1 mol��L-1NaOH��Һ����εμ�0.2 mol��L-1��HN3�������ᣩ��Һ��pH�ı仯������ͼ��ʾ����Һ���ʱ����ı仯���Բ��ƣ��������Ka=10-4.7��������˵����ȷ����
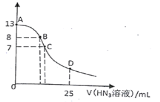
A. 0.1 mol��L-1 NaN3��ҺpHԼΪ8.85
B. ��B�㣬����Ũ�ȴ�СΪc(OH��)>c(H+)>c (Na+)>c(N3��)
C. ��C�㣬�μӵ�V(HN3)<12.5 mL
D. ��D�㣬c(Na+)=2c(HN3)+2 c(N3��)
���𰸡�A
��������
A�����������ˮ�ⷴӦ��ƽ�ⳣ��K=Kw��Ka(HN3)=[c��HN3����c(OH-)]/ c(N3��)= c(OH-)2/ c(N3��)����![]() �����c(OH-)=10-5.15������c(H+)=10-8.85����pHԼΪ8.85����A��ȷ��
�����c(OH-)=10-5.15������c(H+)=10-8.85����pHԼΪ8.85����A��ȷ��
B��B��ʼ��ԣ���c��OH-��>c��H+��������pH=8�����Һ�е������ӡ�����������Ũ�Ƚ�С������ȷ������Ũ�ȴ�СΪ��c��Na+��>c��N3-��>c��OH-��>c��H+������B����
C���μӵ�V��HN3��=12.5 mLʱ��ǡ�÷�Ӧ����NaN3��N3-����ˮ�⣬��Һ�ʼ��ԣ���C����Һ��pH=7������C��V��HN3��>12.5 mL����C����
D��D����Һ�У�c(NaN3)��c(HN3)�����������غ㣬2c(Na��)��c(HN3)��c(N3��)��D�����
��ѡA��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������һ����Ҫ�Ĺ�ҵԭ�ϣ��л���ѧ��ͨ��������Ӧԭ�������Խ��б���������ĺϳɡ��й����ʵ��������ʡ�ʵ��װ��������ʾ��
������ | �״� | ��������� | |
�۵�/�� | 122.4 | ��97 | ��12.3 |
�е�/�� | 249 | 64.3 | 199.6 |
�ܶ�/g��cm��3 | 1.2659 | 0.792 | 1.0888 |
ˮ���� | �� | ���� | ���� |
ʵ��һ����ȡ���������
�ڴ��Թ��м���15g�������һ�����ļ״�������������һ����Ũ���ᣬ��ͼA����������ʵ�顣

(1)��������״���Ӧ�Ļ�ѧ����ʽΪ______________________________________��
(2)��ѧʵ��������ȡ��������ʱΪ��������IJ��ʿ��Բ�ȡ�Ĵ�ʩ��___________________________
ʵ������ᴿ���������
��ʵ��Ҫ������ͼBװ�ð�ͼA���Ʊ��ı��������ˮϴ�ᴿ��������ͼCװ�ý��������ᴿ
(3)��ͼBװ�ý���ˮϴ�ᴿʱ��Bװ���й���Na2CO3������__________________��
(4)��ͼCװ�ý��������ᴿʱ�����¶ȼ���ʾ____________ʱ��������ƿ�ռ������������
(5)������ȡ15g���������������ñ���������IJ���Ϊ______________(С�������1λ��Ч����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʮ�Ŵ� �������Ҫ����Ӯ���챣��ս������ζ�ŶԴ�����Ⱦ���α���ǰ���ߡ���������-�������ӽ���Ĥȼ�ϵ�ؽ���ѧ��ת��ɵ��ܵ�ͬʱ�� ʵ���������ᡢ���硢������λһ��Ľ�ϣ������˳ɱ������Ч�棬 ����ԭ��ͼ��ʾ������˵���������
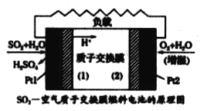
A.Ptl �缫���������ķ�ӦΪ��SO2+ 2H2O-2e- =SO42-+4H+
B.�õ�طŵ�ʱ���Ӵ�Pt l�缫�������·����Pt2�缫
C.Pt2�缫���������ķ�ӦΪO2+4e- =2O2-
D.��ͬ�����£��ŵ���������ĵ� SO2��O2�������Ϊ 2 : 1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ϡ��Ԫ�ذ����֡��ƺ���ϵ����Ce��Eu )��17��Ԫ�أ� ����Ҫ��ս����Դ����ʡϡ����Դ�dz��ḻ��ij��ɫ���ӻ���ʾ�����������в��������ķ�ӫ���ĩ�� ( Eu2O3��SiO2��Fe2O3��CeO2��MnO �����ʣ���ij�������Դ˷�ĩΪԭ�ϣ� ������¹������̶���Դ���л��գ��õ���Ϊ������CeO2��Eu2O3 �������𣩣�
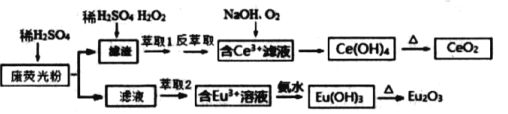
��֪��CeO2 �����ڗN���ᣬҲ������NaOH ��Һ��Eu2O3������ϡ����
(1)�������м�ϡ�����H2O2�����������Ӧ�����ӷ���ʽ____________ ��Ϊ���������ʣ������ʵ���߷�Ӧ�¶ȣ����¶�ƫ�߽����ʷ������С����ԭ����________________________________��
(2)�л���HR�ܽ�Ce3+��ˮ��Һ����ȡ�������ù��̿ɱ�ʾΪ��Ce3+��ˮ�㣩+3HR(�л���)![]() CeR3(�л��㣩+3H+(ˮ�㣩���� CeR3(�л��㣩�м���ϡ������з���ȡ�ܻ�ýϴ��ĺ�Ce3+ˮ��Һ����ƽ��ǶȽ�����ԭ��________________________��
CeR3(�л��㣩+3H+(ˮ�㣩���� CeR3(�л��㣩�м���ϡ������з���ȡ�ܻ�ýϴ��ĺ�Ce3+ˮ��Һ����ƽ��ǶȽ�����ԭ��________________________��
(3)�������ɺ� Ce3+��Һ����Ce(OH)4�����ӷ���ʽ____________________��
(4)ȡ���������еõ���Ce(OH)4 ��Ʒ 0.52 g, �������ܽ����Ũ��Ϊ 0.1000molL-1FeSO4����Һ�ζ����յ�ʱ���汻��ԭΪCe3+ , ���� 24.00 mL ����Һ���ò�Ʒ�� Ce(OH)4����������Ϊ___________��
(5)��֪�� Ce3+��ҺҲ�����ȼӼ�� pH����ͨ�����������ɵõ�Ce(OH)4��298K ʱ,Ksp[Ce(OH)3]=5��10-20������Һ��c(Ce3+)=0.05molL-1, �Ӽ����pH ��_____ʱCe3+��ʼ���������ԼӼ��������Һ����仯����
(6)��ȡ���Խ������ӵ���ȡ���� pH�Ĺ�ϵ��ͼ��ʾ��������Ϊ������ȡ����ȥ�����������ӣ�������ȡ2 �����˵�pH ��_______����ѡ����ţ�����ԭ���� _____��
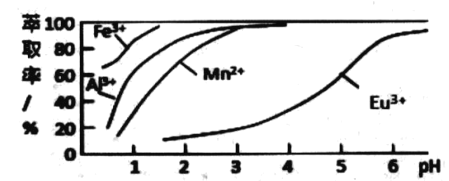
A. 2.0 ���� B . 3.0 ���� C. 5.0 ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ba3N2����һ����Ҫ�Ļ�ѧ�Լ��������£����⻯����BaH2����ͨ�뵪����Ӧ���ɵ�������������ͼװ���Ʊ�����������֪��Ba3N2��ˮ��Ӧ��BaH2�ڳ�ʪ����������ȼ����ˮ��Ӧ������˵������ȷ���ǣ� ��
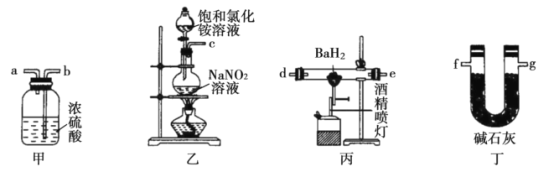
A.��ʵ�����п�����װ�����Ʊ�����
B.ʵ��ʱ���ȵ�ȼװ�ñ��еľƾ���ƣ����ȼװ�����еľƾ���
C.�����������ҵ���ĸ����˳��Ϊc��b��a��d��e��g��f
D.װ�ü��е�Ũ�����װ�ö��еļ�ʯ��������ͬ�����ɷ�ֹˮ��������װ�ñ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ס�����ͬѧ����ͼ��ʾװ�ý���ʵ�飬̽������������Ӧ�IJ��
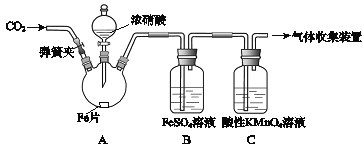
�����أ�
I����Ũ����ͻ��ý�����Ӧ�����У���������Ũ�ȵĽ��ͣ������ɵIJ�����+4��+2����3�۵ȵ��Ļ����
II��FeSO4+NOFe(NO)SO4(��ɫ) ��
III��NO2��NO���ܱ�KMnO4�������ա�
��ʵ������������¼���£�
ʵ����� | ʵ������ |
(1)���ɼУ�ͨ��һ��ʱ��ij���壬�رյ��ɼС� | |
(2)��Һ©����������Ũ���Ỻ��������ƿ�У��رջ����� | ���������� |
(3)������ƿ����Ӧ��ʼ��ֹͣ���ȡ� | ��A���к���ɫ���������һ��ʱ���������ɫ��dz�� B����Һ����ɫ�� C����Һ��ɫ��dz�� �ڷ�Ӧֹͣ��A���й���ʣ�ࡣ |
��ش��������⣺
(1)Ϊ�ų�������ʵ��ĸ��ţ�����(1)��ͨ������������________________��
(2)����Ũ�������ǰû�����������ԭ����__________________________��
(3)��д��������ƿ��A���к���ɫ��������Ļ�ѧ����ʽ_______________��
(4)����ΪB����Һ����ɫ����ΪA����NO���ɣ�����Ϊ�Ĺ۵����_________(����ȷ�����)�����Ϸ���ʽ����ԭ�� ________________________________��
(5)�����Ƿ����ɩ�3�۵��Ļ����Ӧ���е�ʵ�������________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Cr2O3�������ʶ��أ���ұ�����ϵ��������Ų�������ĵ�λ��һ�����õ���ˮ�Ȼ�ԭ�������Ʊ��������Ĺ���������ͼ��
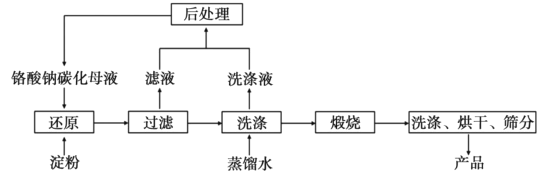
��֪����������Na2CO3�ĸ����Ƽ�����Һ��ͨ��CO2���Ƶò�̼ͬ���ʵĸ�����̼��ĸҺ��
������ԭ����Ӧ���ҷ��ȣ����Ƶ�Cr(OH)3���ϡ�
��1���ù���������ԭ����Ӧ���ʹ�õ������ǻ��ȩ���������ü۸�����ĵ��ۡ���д����ȩ��HCHO��������ƣ�Na2CrO4����Һ��Ӧ�����ӷ���ʽ__��
��2������Ͼ��ȵ���Һ���뷴Ӧ�����ܱս��裬���·�������ԭ����Ӧ�������й�˵���������__�����ţ���
A.�÷�Ӧһ��������ȼ��ɽ���
B.��Ҫʱ��ʹ����ȴˮ�����¶ȿ���
C.�����ƿ��ʵ�������ʹ���۳�ַ�Ӧ
D.Ӧ�����ˮ���ճأ����պ�����ˮ
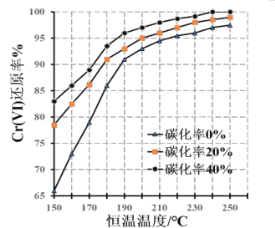
��3����÷�Ӧ��ɺ��ڲ�ͬ�����¶ȡ���̼ͬ������Cr(��)��ԭ����ͼ��ʵ������������Cr(��)��ԭ�ʿɸߴ�99.5%���ϣ�����ԭ���β��õ���ѷ�Ӧ����Ϊ_��__��
��4����Һ����������Ϊ__����ˮ�ȷ��Ʊ����������յ��ŵ���__��__��д���������ɣ���
��5����ˮ�ȷ��Ʊ�����������Ϊ������������[2Cr(OH)3H2O]����ϴ�Ӳ����������������˱�������գ�ʧȥ������������������Ϊ_��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA���������ӵ�������ֵ�������й�������ȷ����
A. ��״���£�2.24LCl2��������NaOH��Һ��Ӧ��ת�Ƶĵ�����ĿΪ0.2NA
B. ��״���£�44.8 L NO��22.4 L O2��Ϻ������з�����������2NA
C. NO2��H2O��Ӧÿ����2 mol HNO3ʱת�Ƶĵ�����ĿΪ2NA
D. 1 mol Fe�������г��ȼ��ʧȥ3NA������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ڵĶ���Ԫ�ؼ��仯�����ڻ�����ҽҩ�����ϵ��������Ź㷺��Ӧ�á��ش��������⣺
(1) ��̬Tiԭ���У�����ܲ���ӵĵ�����������״Ϊ___����Tiͬ���ڵ����й���Ԫ�صĻ�̬ԭ���У�д������һ���������������Ѳ�ͬ��Ԫ����Χ�����Ų�ʽ_____��
(2) ����������Ƭ������ȱ����ƶѪ��Ԥ�������Ƶij���ҩ��ٴ��������ά����C�ٽ��������������գ���������Fe3+���ӽṹ�Ƕ�������Fe2+�ױ�������Fe3+��ԭ����_________________��
(3) SCN�� ������Fe3+�ļ��飬д����SCN�� ��Ϊ�ȵ������һ������_____��
(4) �������ſڴƻ����еĴƻƷ���ʽΪAs2S3�����ӽṹ��ͼ��Asԭ�ӵ��ӻ���ʽΪ______���ƻƺ�SnCl2�������з�Ӧת��Ϊ�ۻ�(As4S4)��SnCl4���ų�H2S���壬д���÷�Ӧ����ʽ��__________________��SnCl4���ӵ����幹��Ϊ_______��
(5)���ʯ(TiO2)�Ǻ��ѵ���Ҫ����֮һ�����е��͵��ķ���ϵ�ṹ���侧���ṹ(��������ͬλ�õ�ԭ����ͬ)��ͼ��ʾ(ע�⣺D��������)��
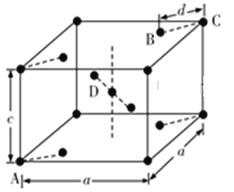
��4����A��B��C��D�У�������ԭ�ӵ���________________��
����A��B��Cԭ�ӵ�����ֱ�ΪA(0��0��0)��B(0.69a��0.69a��c)��C(a��a��c)����Dԭ�ӵ�����ΪD(0.19a��____�� ____)������������߳�Ϊx�����������ļ���d=_______(�ô���ʽ��ʾ)��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com