
|
氯酸钾和亚硫酸氢钠发生氧化还原反应:ClO3-+3HSO3-
| |
| [ ] | |
A. |
反应开始时速率增大可能是c(H+)增大引起的 |
B. |
纵坐标为v(Cl-)的速率——时间曲线与图中曲线能完全重合 |
C. |
后期反应速率下降的原因是反应物浓度减小 |
D. |
图中阴影部分“面积”为t1至t2时间内的ClO3-的物质的量的减小值 |
 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:

(1)反应开始时,反应速率加快的原因是_____________________________________________。
(2)反应后期,反应速率又下降的原因是_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:

(1)写出该反应的离子方程式____________________________;
(2)为什么反应开始时速率加快____________________________;
为什么后期反应速率下降____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:

(1)反应开始反应速率加快的原因是________________________________________。
(2)反应后期反应速率下降的原因是________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:

图9-4?
(1)为什么反应开始一段时间内速率逐渐加快? 。?
(2)为什么后期反应速率逐渐减慢? 。?
查看答案和解析>>
科目:高中化学 来源: 题型:
氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl(-1价)和S(+6价)的速率如图曲线所示,已知ClO3-的氧化性随c(H+)的增大而增强,有关方程式为:
ClO3-+3 HSO3-![]() Cl-+3 H+ +3 SO42-
Cl-+3 H+ +3 SO42-
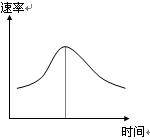
(1)反应开始时反应速率加快的原因是 ![]() ;
;
(2)反应后期反应速率下降的原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com