
【题目】已知甲为恒温、恒压容器,乙为恒温、恒容容器。两容器中均充入1 mol N2、3 mol H2,初始时两容器的温度、体积相同。一段时间后反应达到平衡,为使两容器中的N2在平衡混合物中的物质的量分数相同,下列措施中可行的是 ( )
A.向甲容器中充入一定量的氦气
B.向乙容器中充入一定量的N2
C.升高乙容器的温度
D.增大甲容器的压强
【答案】A
【解析】
甲为恒温恒压容器,乙为恒温恒容容器,初始时两容器的温度、体积相同,合成氨反应是一个气体体积缩小的可逆反应,反应达到平衡时甲的体积小于乙的体积,相当于在乙的基础上增大压强,缩小体积,平衡正向移动,甲中氮气的转化率高,甲中氮气的物质的量分数小;为使两容器中的N2在平衡混合物中的物质的量分数相同,可以提高甲中氮气的物质的量分数或者减小乙中氮气的物质的量分数。
A. 向甲容器中充入一定量的氦气,使甲中的容积增大,相当于减小压强,平衡向左移动,提高了甲中氮气的物质的量分数,故A可行;
B. 向乙容器中充入一定量的N2气体,提高了乙中氮气的物质的量分数,故B不可行;
C. ![]() ,升温平衡左移,提高了乙中N2的物质的量分数,故C不可行;
,升温平衡左移,提高了乙中N2的物质的量分数,故C不可行;
D. 增大甲容器的压强,平衡右移,减小了甲中N2的物质的量分数,故D不可行;
答案选A。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是
A.25 ℃,pH=12的Na2CO3溶液中含有OH-的数目为0.01NA
B.1 mol苯乙烯(![]() )中含有的碳碳双键数为4NA
)中含有的碳碳双键数为4NA
C.加热条件下,4.6 g金属Na与足量O2反应的产物中阳离子和阴离子总数为0.3NA
D.常温时,1 L 0.1 mol·L-1的硝酸铵溶液中,NH4+和H+总数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定质量的镁、铝混合物投到2 mol·L-1的盐酸中,待金属完全溶解后,向溶液中加入2 mol·L-1的氢氧化钠溶液,生成沉淀的质量与加入氢氧化钠溶液的体积关系如图所示。则:
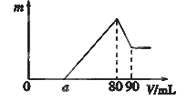
(1)80-90ml对应反应的离子方程式_____________;
(2)金属铝的质量为____________g;
(3)盐酸的体积是____________mL;
(4)a的取值范围是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+3B(g)![]() 2C(g)+2D(g)在四种不同情况下的反应速率如下,其中表示反应速率最快的是( )
2C(g)+2D(g)在四种不同情况下的反应速率如下,其中表示反应速率最快的是( )
A. v(A)=0.15 mol·L-1·min-1B. v(B)=0.01 mol·L-1·s-1
C. v(C)=0.40 mol·L-1·min-1D. v(D)=0.45 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质不能实现直接转化的是( )
A.C→CO2→NaHCO3→Na2CO3
B.Al→Al(OH)3→Al2O3→NaAlO2
C.Na→NaOH→Na2CO3→NaHCO3
D.Na→Na2O2→Na2CO3→NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银铜合金广泛应用于航空工业。从银铜合金的切割废料中回收银和制备CuAlO2的流程
如下。
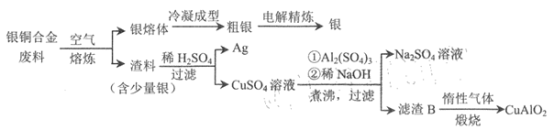
已知:Al(OH) 3和Cu(OH) 2开始分解的温度分别为450℃和 80℃。 下列说法错误的是
A.电解精炼时,粗银做阳极,纯银做阴极
B.为提高原料利用率,流程中应加过量的稀NaOH
C.滤渣B煅烧时发生的反应为 4CuO+4Al(OH)3![]() 4CuA1O2+ O2↑+6H2O
4CuA1O2+ O2↑+6H2O
D.若用 1.0 kg 银铜合金(铜的质量分数为64%) 最多可生成 10.0mol CuA1O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中药葛根是常用祛风解表药物,它的有效成分为葛根大豆甙元 F, 已用于治疗高血压引起的头疼、头晕、突发性耳聋等症。以下是以 A 为起始原料合成F 的一种方法:

回答下列问题:
(1) A 的化学名称为________________,B分子式为________________。
(2) C 中官能团的名称为________ , C→D的反应类型为 ______________。
(3)l molE 最多可与_____________________molH2 发生加成反应。
(4) F 与NaOH 溶液反应的化学方程式为 ________________。
(5)B 有多种同分异构体,同时满足下列条件的共有________种。
①属于芳香族化合物 ②可与NaHCO3溶液反应放出 CO2气体.其中,核磁共振氢谱有4 组峰,且峰面积之比为1:2:6:1的结构简式为 _________________(写出一种即可).
(6)已知:![]() 写出以A为原料制备化合物
写出以A为原料制备化合物![]() 合成路线____________________________ 。(无机试剂任选)
合成路线____________________________ 。(无机试剂任选)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将SO2分别通入下列4种溶液中,有关说法正确的是( )
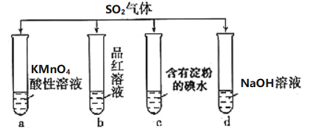
A.试管a中实验可以证明SO2具有漂白性
B.试管b中溶液褪色,说明SO2具有强氧化性
C.试管c中蓝色退去,说明还原性:SO2>I-
D.试管d中无明显现象,说明SO2不是酸性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取气体装置一般由发生装置、净化装置、收集装置以及尾气吸收装置组成。以Cl2的实验室制法为例(见下图):
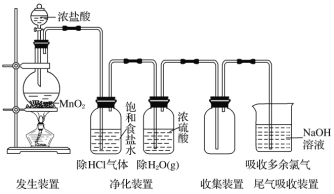
(1)反应原理:用强氧化剂(如KMnO4、K2Cr2O7、KClO3、MnO2等)氧化浓盐酸。MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(2)制备装置类型:固体+液体![]() 气体
气体
(3)净化方法:用___________________除去HCl,再用浓硫酸除去水蒸气。
(4)收集方法:________________法或排饱和食盐水法。
(5)尾气吸收:用强碱溶液(如NaOH溶液)吸收,不用Ca(OH)2溶液吸收的原因是_________________________________________________________________________。
(6)验满方法:将湿润的淀粉-KI试纸靠近盛Cl2的试剂瓶口,观察到__________________,则证明已集满;或将湿润的_________________靠近盛Cl2的试剂瓶口,观察到试纸先变红后褪色,则证明已集满。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com