
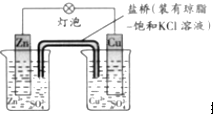
| A、撤掉盐桥不能形成闭合回路,所以不能形成原电池 |
| B、电池反应为Zn+Cu2+═Zn2++Cu |
| C、在外电路中,电子从负极流向正极 |
| D、每生成1molCu,通过盐桥的电子为2mol |


 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
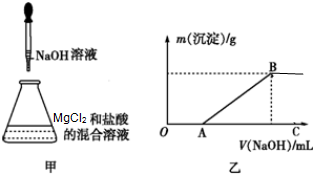 某同学称取一定量的MgCl2固体配成溶液,在该溶液中先加入一定量的稀盐酸,然后逐滴加入NaOH溶液(如图甲所示)
某同学称取一定量的MgCl2固体配成溶液,在该溶液中先加入一定量的稀盐酸,然后逐滴加入NaOH溶液(如图甲所示)查看答案和解析>>
科目:高中化学 来源: 题型:
| A、二者在水中的溶解度不同,碳酸氢钠的溶解度大于碳酸钠的溶解度 |
| B、二者热稳定性不同,碳酸氢钠的热稳定性大于碳酸钠的热稳定性 |
| C、二者都能与盐酸反应放出二氧化碳气体,但碳酸钠生成的气体的速率更快 |
| D、等浓度时,碳酸钠溶液的PH大于碳酸氢钠溶液的PH |
查看答案和解析>>
科目:高中化学 来源: 题型:
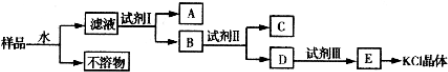
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com