
下列实验操作和理象、结论均正确且有因果关系的是
选项 | 实验操作和现象 | 结论 |
A | 向某溶液中滴加CCl4,振荡、静置,下层溶液显紫色 | 原溶液中含有I- |
B | 常温下,0.1mol/LNaHSO3溶液的pH约为5 | HSO3-的电离程度大于其水解程度 |
C | 相同温度下,测得饱和亚硫酸溶液的pH小于饱和碳酸溶液的pH | 亚硫酸的酸性强于碳酸 |
D | 向稀HNO3中加入过量的Fe粉,充分反应后,滴入KSCN溶液不显红色 | 稀HNO3将Fe氧化为Fe2+ |
A. A B. B C. C D. D
 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源:2016-2017学年甘肃省天水市高二下学期开学考试(寒假作业检测)化学试卷(解析版) 题型:选择题
在一定温度下,下列叙述是可逆反应A(g)+3B(g) 2C(g)在定容密闭容器中达到平衡的标志的是
2C(g)在定容密闭容器中达到平衡的标志的是
①C的生成速率与C的分解速率相等;
②单位时间内amol A生成,同时生成3amol B;
③A、B、C的浓度不再变化;
④混合气体的总压强不再变化;
⑤混合气体的平均摩尔质量不再变化;
⑥用A、B、C的物质的量浓度变化表示的反应速率之比为1:3:2;
⑦A、B、C的分子数目比为1:3:2;
⑧混合气体的密度不再变化。
A. ②⑤ B. ①③④⑤ C. ②⑥⑦⑧ D. ⑤⑥⑧
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省庄河市高一上学期期末考试化学试卷(解析版) 题型:选择题
下列化合物中,可以通过置换反应一步得到的是( )
①FeSO4 ②NaOH ③Fe3O4 ④Al2O3
A. ①②③④ B. ①②③ C. ①④ D. ①③
查看答案和解析>>
科目:高中化学 来源:2017届广西省高三2月份模拟演练理综化学试卷(解析版) 题型:选择题
常温下,0.1000mol·L-1NaOH溶液分别滴定20.00mL浓度均为0.1000mol·L-1的两种一元酸HX、HY溶液,滴定曲线如图所示。下列说法正确的是

A. HX是强酸,HY是弱酸
B. V[NaOH(aq)]=10.00mL时,
C. V[NaOH(aq)]=20.00mL时,所得的两种溶液的pH均等于7
D. V[NaOH(aq)]=20.00mL时,所得的两种溶液的导电性,HX的比HY的强
查看答案和解析>>
科目:高中化学 来源:2017届山东省淄博市高三第一次模拟考试化学试卷(解析版) 题型:实验题
锰酸锂(LiMn2O4)可作为锂离子电池的正极材料。工业上利用软锰矿浆吸收含硫烟气(SO2 和O2)制备锰酸锂,生产流程如下:
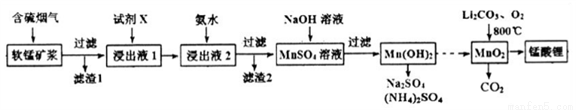
已知:①软锰矿主要成分为MnO2,含少量Fe2O3、FeO、Al2O3、SiO2等杂质。
②软锰矿浆在吸收含硫烟气的过程中酸性逐渐增强。
③部分氢氧化物沉淀相关的溶液pH如下表:

(1)已知:

下列措施可提高SO2吸收率的是__________(填序号)
a.降低通入含硫烟气的温度 b.升高通入含硫烟气的温度
c.减少软锰矿浆的进入量 d.减小通入含硫烟气的流速
(2)加入试剂X能提高产品纯度,则X可以是_____________(填化学式)
(3)加氨水调溶液pH在5~6之间,目的是_______________。
(4)锰酸锂可充电电池的总反应式为:Li1-xMnO2+LixC  LiMn2O4+C(x<1)
LiMn2O4+C(x<1)
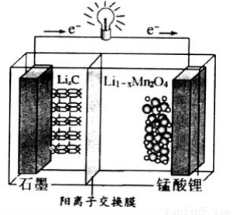
①放电时,电池的正极反应式为__________________
②充电时,若转移1mole-,则石墨电极将增重__________g。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省盐城市高二学业水平模拟(一)化学试卷(解析版) 题型:简答题
KIO3是一种无色易溶于水的晶体,医药上可作防治地方甲状腺肿的药剂,目前碘酸钾被广泛应用于食盐加碘。一种由含碘废水制取碘酸钾的工艺如下:

(1) 检验“含碘废水”中含有的单质I2,常用的试剂是________。
(2) 进行“过滤1”时,需同时对CuI沉淀进行洗涤。在洗涤过滤滤液中可通过滴加________盐溶液来检验其是否已洗涤干净。
(3) “滤渣2”的成分为____________(填化学式)。
(4) “制KI”时,发生反应的化学方程式为____________。
(5) 江苏食用加碘盐新标准是每千克食盐中碘元素含量为25毫克(波动范围为18~33 mg/kg)。测定食盐试样中碘元素含量的步骤如下:称取4.000 g市售食盐加入锥形瓶中,依次加入适量的水、稍过量KI及稀硫酸;充分反应后,再加入12.00 mL 6.000×10-4 mol·L-1 Na2S2O3溶液,与生成的碘恰好完全反应。有关反应原理为:
KIO3+5KI+3H2SO4===3K2SO4+3I2+3H2O; I2+2S2O ===2I-+S4O
===2I-+S4O 。
。
①计算该食盐试样中碘元素的含量(单位mg/kg,写出计算过程)。
_______
②该食盐试样是否符合江苏食用加碘盐新标准并说明判断依据。
_______
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省盐城市高二学业水平模拟(一)化学试卷(解析版) 题型:选择题
用蘸有浓氨水的棉棒检漏输氯管道的原理为:3Cl2+8NH3=N2+6NH4Cl。该反应的下列说法正确的是( )
A. 35.5 g氯气所含的分子数为6.02×1023
B. 常温常压下,22.4 L氨气所含原子总数为4×6.02×1023
C. 反应每生成1 mol N2转移电子数约为6×6.02× 1023
D. 1 mol·L-1 NH4Cl溶液中,含有Cl-数约为6.02×1023
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省盐城市高二学业水平模拟(一)化学试卷(解析版) 题型:选择题
我国首飞的长征七号运载火箭采用液氧和煤油作为推进剂。煤油属于( )

A. 纯净物 B. 混合物 C. 氧化物 D. 单质
查看答案和解析>>
科目:高中化学 来源:2017届江苏省常州市高三第一次模拟考试化学试卷(解析版) 题型:填空题
碱式次氯酸镁[Mga(ClO)b(OH)c·xH2O]是一种有开发价值的微溶于水的无机抗菌剂。为确定碱式次氯酸镁的组成,进行如下实验:
① 准确称取1.685g碱式次氯酸镁试样于250mL锥形瓶中,加入过量的KI溶液,用足量乙酸酸化,用O.8000mol/LNa2S2O3标准溶液滴定至终点(离子方程式为2S2O32-+I2=2I-+S4O62-),消耗25.00mL。
② 另取1.685g碱式次氯酸镁试样,用足量乙酸酸化,再用足量3%H2O2溶液处理至不再产生气泡(H2O2被ClO-氧化为O2),稀释至1000mL。移取25.00mL溶液至锥形瓶中,在一定条件下用0.020 00mol/L EDTA(Na2H2Y)标准溶液滴定其中的Mg2+(离子方程式为Mg2++H2Y2-=MgY2-+2H+) ,消耗25.00 mL
(1)步骤① 中需要用到的指示剂是_______。
(2)步骤② 中若滴定管在使用前未用EDTA标准溶液润洗,测得的Mg2+物质的量将____(填“偏高”、“偏低”或“不变”)。
(3)通过计算确定碱式次氯酸镁的化学式(写出计算过程)。____
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com