
| 0.528g |
| 44g/mol |
| 0.144g |
| 0.352g |
| 0.144g |
| 18g/mol |
| 0.016g |
| 0.352g |


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
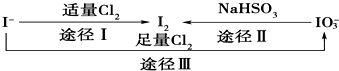
| A、可用淀粉-KI试纸和食醋检验加碘盐中是否含有碘 |
| B、在碘水中通入Cl2,发生反应的化学方程式为5Cl2+I2+6H2O═2HIO3+10HCl |
| C、由图可知氧化性的强弱顺序为:Cl2>I2>IO3- |
| D、途径Ⅲ中若消耗1 mol Cl2,反应中转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
 实验室里常见到如图所示仪器,该仪器为两头密封的玻璃管,中间带有一根玻璃短柄.该仪器可进行多项实验.当玻璃管内装有碘晶体时,用此仪器可进行碘升华实验,具有装置简单、操作方便、现象明显、没有污染,可反复使用等优点.
实验室里常见到如图所示仪器,该仪器为两头密封的玻璃管,中间带有一根玻璃短柄.该仪器可进行多项实验.当玻璃管内装有碘晶体时,用此仪器可进行碘升华实验,具有装置简单、操作方便、现象明显、没有污染,可反复使用等优点.查看答案和解析>>
科目:高中化学 来源: 题型:

| A、若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液褪色 |
| B、实验仪器D可以起到防止溶液倒吸的作用 |
| C、若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先产生白色沉淀后沉淀又溶解 |
| D、若A为浓H2SO4,B为Cu,C中盛有澄清石灰水,则C中变浑浊 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用过滤法分离Fe(OH)3胶体和FeCl3溶液的混合物 |
| B、用结晶法提纯NaCl和KNO3的混合物中的KNO3 |
| C、用蒸馏法分离乙醇和苯酚的混合物 |
| D、除去FeCl2溶液中的少量FeCl3:加入足量铁屑,充分反应后,过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 9 |
| 3 |
| 10 |
| 2 |
| 9 |
| 1 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、-313.5kJ/mol |
| B、+313.5kJ/mol |
| C、-80.0kJ/mol |
| D、+80.0kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH4?14H2O |
| B、CH4?8H2O |
| C、CH4?7H2O |
| D、CH4?6H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com