
 实验室里常见到如图所示仪器,该仪器为两头密封的玻璃管,中间带有一根玻璃短柄.该仪器可进行多项实验.当玻璃管内装有碘晶体时,用此仪器可进行碘升华实验,具有装置简单、操作方便、现象明显、没有污染,可反复使用等优点.
实验室里常见到如图所示仪器,该仪器为两头密封的玻璃管,中间带有一根玻璃短柄.该仪器可进行多项实验.当玻璃管内装有碘晶体时,用此仪器可进行碘升华实验,具有装置简单、操作方便、现象明显、没有污染,可反复使用等优点.

科目:高中化学 来源: 题型:
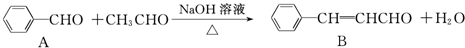
| A、只有①②⑤ |
| B、只有③④⑤ |
| C、只有④⑤⑥ |
| D、只有②⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
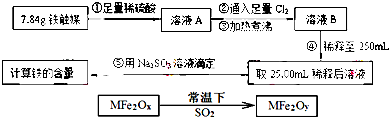
查看答案和解析>>
科目:高中化学 来源: 题型:
 某化学兴趣小组,模拟测定硫酸工业生产中SO2、N2和O2混合气体中SO2的体积分数,选用了下列简易实验装置:
某化学兴趣小组,模拟测定硫酸工业生产中SO2、N2和O2混合气体中SO2的体积分数,选用了下列简易实验装置:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用胶头滴管滴加少量液体 |
| B、用药匙取用粉末状或小颗粒状固体 |
| C、给盛有2/3体积液体的试管加热 |
| D、倾倒液体时试剂瓶标签面向手心 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com