
【题目】某温度下,在2 L的密闭容器中,加入4 mol A和2 mol B进行如下反应:3A(g)+2B(g) ![]() 4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol C,下列说法正确的是
4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol C,下列说法正确的是
A.该反应的化学平衡常数表达式是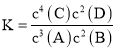
B.增加B,平衡向右移动,B的平衡转化率增大
C.增大该体系的压强,平衡向右移动,化学平衡常数增大
D.此时,B的平衡转化率是40%
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某有机物结构简式为![]() ,下列叙述不正确的是( )
,下列叙述不正确的是( )
A.1mol该有机物在加热和催化剂作用下,最多能和4molH2反应
B.该有机物能使溴水褪色,也能使酸性KMnO4溶液褪色
C.该有机物在一定条件下能发生消去反应或取代反应
D.该有机物遇硝酸银溶液产生白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学方程式或离子方程式正确的是( )
A.用醋酸去除水垢:CaCO3+2H+=Ca2++H2O+CO2↑
B.甲醛与足量新制Cu(OH)2浊液反应:HCHO+2Cu(OH)2![]() HCOOH+Cu2O↓+2H2O
HCOOH+Cu2O↓+2H2O
C.实验室用液溴和苯在催化剂作用下制溴苯:![]() +Br2
+Br2![]()
![]() +HBr
+HBr
D.将CO2通入苯酚钠溶液:2![]() +CO2+H2O→2
+CO2+H2O→2![]() +Na2CO3
+Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯氧化铜[xCuO·yCuCl2·zH2O]在农业上用作杀菌剂。工业上用铜矿粉(主要含Cu2(OH)2CO3、Fe3O4等)为原料制取氯氧化铜的流程如下:
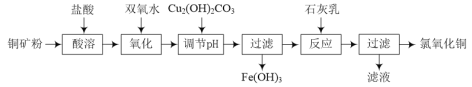
⑴“调节pH”并生成Fe(OH)3时反应的离子方程式为______。
⑵调节pH,要使常温溶液中c(Cu2+)≥0.022mol·L-1,而c(Fe3+)≤1×10-6mol·L-1,则应调节pH的范围为______。{已知Ksp[Cu(OH)2=2.2×10-20],Ksp[Fe(OH)3=1×10-36]}
⑶为测定氯氧化铜的组成,现进行如下实验:
步骤Ⅰ:称取0.4470 g氯氧化铜,放入锥形瓶,加入一定量30%的硝酸使固体完全溶解。滴加K2CrO4溶液作指示剂,用0.1000mol·L-1 AgNO3标准溶液滴定溶液中的Cl-,滴定至终点时消耗AgNO3标准溶液20.00 mL;
步骤Ⅱ:称取0.4470g氯氧化铜,放入锥形瓶,加入一定量硫酸使固体完全溶解。向溶液中加入过量的KI固体,充分反应后向溶液中滴入数滴淀粉溶液,用0.2000mol·L-1Na2S2O3标准溶液滴定,滴定至终点时消耗Na2S2O3标准溶液20.00mL。
已知步骤Ⅱ中所发生的反应如下:
2Cu2++4I-=2CuI↓+I2 2Na2S2O3+I2=2NaI+Na2S4O6
①已知Ag2CrO4为砖红色沉淀,步骤Ⅰ滴定终点时的实验现象是_______。
②通过计算确定氯氧化铜的化学式________________(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种光化学电池的结构如图所示,电池总反应为AgCl(s)+ Cu+(aq) = Ag(s)+Cu2+(aq)+Cl-(aq),下列关于该电池在工作时的说法中不正确的是

A.电子的运动方向:Pt→外电路→Ag→内电路→PtB.生成108 g银,转移的电子为1 mol
C.Cu+在负极发生氧化反应D.Cl-由正极迁移到负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,科学家已成功合成了少量N4,有关N4的说法正确的是( )
A.N4与N2化学性质相似
B.N4与N2互为同位素
C.相同质量的N4和N2含原子个数比为1:1
D.N4的摩尔质量是56g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)可以除去自来水中的氯气,在水产养殖上被广泛应用。用纯碱和硫化碱(主要成分Na2S,含少量Na2SO4、Na2CO3等)为原料制备Na2S2O3·5H2O的实验流程如下:

回答下列问题:
(1)试剂X是一种二元化合物的钡盐,它与Na2SO4反应的化学方程式为___________________。
(2)用热水溶解并趁热过滤的目的是______________________。
(3)利用SO2与Na2CO3、Na2S的混合溶液反应制备Na2S2O3,所需仪器如下图:
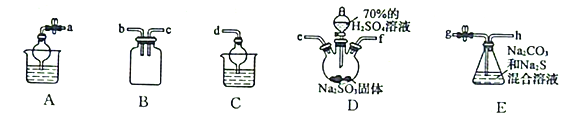
①从左到右连接各仪器,导管的接口顺序为:___________接e、f接___________、___________接___________、___________接d。___________
②E中发生反应的离子方程式为______________________。
③装置B的作用是______________________。
(4)操作1包括蒸发浓缩、______________________、___________、洗涤、干燥
(5)为测定产品Na2S2O3·5H2O的纯度,准确称取12.4gNa2S2O3·5H2O产品,配制成100mL溶液,取25.00mL溶液,以淀粉溶液作指示剂,用0.2500mol·L-1碘的标准溶液滴定,发生反应2S2O32-+I2= S4O62-+2I-,消耗碘的标准溶液20.00mL,则该产品的纯度为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景,可以用多种方法合成。
Ⅰ.用CO2生产甲醇
(1)已知:H2的燃烧热为-285.8 kJ/mol,CH3OH(l)的燃烧热为-725.8kJ/mol,CH3OH(g)= CH3OH(l)△H=-37.3 kJ/mol,则CO2(g)+3H2(g)![]() CH3OH(g)+H2O(l)△H=_______kJ/mol。
CH3OH(g)+H2O(l)△H=_______kJ/mol。
(2)将CO2和H2按物质的量之比1:3充入体积为2.0 L的恒容密闭容器中反应,如图两条曲线分别表示压强为0.1 M Pa和5.0 MPa下CO2转化率随温度的变化关系。
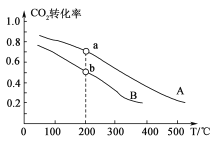
①其中a点的平衡常数表达式为:_________________。
②a,b两点化学反应速率分别用va、vb表示,则va________vb (填“大于”、“小于”或“等于”)。
(3)在1.0 L恒容密闭容器中投入1 mol CO2和2.75 mol H2发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示,下列说法正确的是___________。
CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示,下列说法正确的是___________。
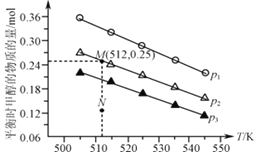
A. 该反应的正反应为放热反应
B. 压强大小关系为p1<p2<p3
C. M点对应的平衡常数K的值约为1.04×10-2
D. 在p2及512K时,图中N点v(正)<v(逆)
Ⅱ.用![]() 生产甲醇
生产甲醇
(4)已知:CO(g)+2H2(g)![]() CH3OH(g),如图是该反应在不同温度下CO的转化率随时间变化的曲线。
CH3OH(g),如图是该反应在不同温度下CO的转化率随时间变化的曲线。
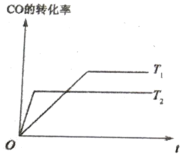
①该反应的焓变△H ______0(填“>”、“<”或“=”)。
②T1和T2温度下的平衡常数大小关系是K1_________K2(填“>”“<”或“=”)。
Ⅲ.甲醇的应用
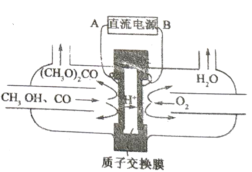
(5)以甲醇为主要原料,电化学合成碳酸二甲酯的工作原理如图所示。阳极的电极反应式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.激素类药物乙烯雌酚的结构简式为: ,它的分子式是:C18H20O2
,它的分子式是:C18H20O2
B.等质量的甲烷、乙烯、乙醇分别充分燃烧,所耗用氧气的量依次减少
C.聚乳酸(![]() )是由单体之间通过加聚反应合成的
)是由单体之间通过加聚反应合成的
D.实验证实![]() 可使溴的四氯化碳溶液褪色,说明该分子中存在碳碳双键
可使溴的四氯化碳溶液褪色,说明该分子中存在碳碳双键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com