
明矾具有抗菌、收敛等作用,可作中药及净水剂等,4.74g的明矾晶体[KAl(SO4)2·12H2O]受热脱水的过程中的热重曲线m~n(样品的质量随温度变化的曲线)如下。
请回答下列问题:
(1)试确定70℃时固体物质的化学式____________________ (要求写出推断过程)。
(2)写出200℃时发生反应的化学方程式______________________________。
(3)在770℃时充分灼烧,最后得到固体产物A及气体B,B能全部溶解在BaCl2溶液中并形成白色沉淀;A可部分溶于水,过滤后得到固体C和滤液D,向D中加入BaCl2溶液也能得到白色沉淀,将C置于适量的NaOH溶液中恰好反应得到澄清的溶液E。则n中固体成分是的_________,质量分别为__________B的化学式为________。
(1)KAl(SO4)2·3H2O;(2) KAl(SO4)2·3H2O  KAl(SO4)2 +3H2O;(3) Al2O3、K2SO4;0.51 g; 0.87g;SO3。
KAl(SO4)2 +3H2O;(3) Al2O3、K2SO4;0.51 g; 0.87g;SO3。
解析试题分析:(1)由图像分析可知:温度升至200℃,固体质量由4.74g变为2.58g,结合KAl(SO4)2·12H2O的摩尔质量(474 g/mol)和 KAl(SO4)2的摩尔质量(258g/mol)可知:该过程为0.01molKAl(SO4)2·12H2O失去全部结晶水转化为0.01mol KAl(SO4)2的过程,则温度升至64.5℃时为明矾晶体失去部分结晶水,即固体由KAl(SO4)2·12H2O变为KAl(SO4)2·xH2O,即KAl(SO4)2·xH2O的质量为3.12g,但固体的物质的量不变仍为0.01mol,KAl(SO4)2·xH2O的摩尔质量为312 g/mol,求得x=3,化学式为KAl(SO4)2·3H2O;(2)由(1)的分析结合图像知200℃时固体由KAl(SO4)2·3H2O变为KAl(SO4)2,发生反应的化学方程式KAl(SO4)2·3H2O  KAl(SO4)2 +3H2O;(3)根据题意知:在770℃时充分灼烧为KAl(SO4)2的分解过程,最后得到固体产物A及气体B,B能全部溶解在BaCl2溶液中并形成白色沉淀,可知气体B为SO3,白色沉淀为BaSO4;向滤液D中加入BaCl2溶液也能得到白色沉淀BaSO4,滤液D中含有K2SO4,将不溶固体C置于适量的NaOH溶液中恰好反应得到澄清的溶液,C为Al2O3,即n中固体成分是的Al2O3和K2SO4;KAl(SO4)2·12H2O的物质的量为0.01mol,根据原子守恒知Al2O3的物质的量为0.005mol,质量为0.51 g,K2SO4的物质的量为0.005mol,质量为0.87g。
KAl(SO4)2 +3H2O;(3)根据题意知:在770℃时充分灼烧为KAl(SO4)2的分解过程,最后得到固体产物A及气体B,B能全部溶解在BaCl2溶液中并形成白色沉淀,可知气体B为SO3,白色沉淀为BaSO4;向滤液D中加入BaCl2溶液也能得到白色沉淀BaSO4,滤液D中含有K2SO4,将不溶固体C置于适量的NaOH溶液中恰好反应得到澄清的溶液,C为Al2O3,即n中固体成分是的Al2O3和K2SO4;KAl(SO4)2·12H2O的物质的量为0.01mol,根据原子守恒知Al2O3的物质的量为0.005mol,质量为0.51 g,K2SO4的物质的量为0.005mol,质量为0.87g。
考点:考查图像分析能力及守恒法计算。


 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案科目:高中化学 来源: 题型:填空题
我国从澳大利亚进口的某高炉生铁(用A表示)的成分如下(其余是铁):
| C | Si | Mn | P | S |
| 4.070% | 2.900% | 0.495% | 0.165% | 0.010% |
| | FeO | Fe2O3 | CaO |
| 烟尘煅烧前(%) | 86.40 | 4.00 | 9.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铝是一种应用广泛的金属,工业上用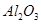 和冰晶石(
和冰晶石(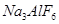 )混合熔融电解制得。
)混合熔融电解制得。
①铝土矿的主要成分是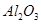 和
和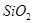 等。从铝土矿中提炼
等。从铝土矿中提炼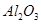 的流程如下:
的流程如下: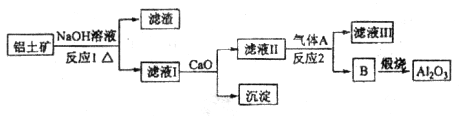
②以萤石(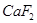 )和纯碱为原料制备冰晶石的流程如下:
)和纯碱为原料制备冰晶石的流程如下: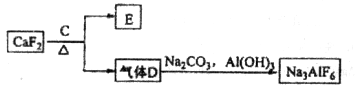
回答下列问题:
(1)写出反应1的化学方程式_________________________、________________________________;
(2)滤液Ⅰ中加入 生成的沉淀是___________,反应2的离子方程式为____ ___________________
生成的沉淀是___________,反应2的离子方程式为____ ___________________
(3)E常用作制作豆腐的添加剂,化合物C是____,写出由D制备冰晶石的化学方程式_______________;
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铁及其化合物之间的相互转化可用下式表示: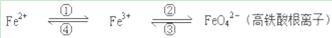
回答下列有关问题:
(1)铁元素在周期表中的位置是___________________________。
(2)Fe与过量稀硫酸反应可以制取FeSO4。若用反应所得的酸性溶液,实现上述①的转化,要求产物纯净,可选用的试剂是________(选填序号)。
A.Cl2 B.Fe C.HNO3 D.H2O2
(3)上述转化得到的硫酸铁可用于电化浸出黄铜矿精矿工艺。精矿在阳极浸出的反应比较复杂,其中有一主要反应CuFeS2+4Fe3+=Cu2++5Fe2++2S(CuFeS2中S为-2价),下列说法正确的是________(选填序号)。
A.从物质分类的角度看,黄铜矿属于合金
B.反应中,所有铁元素均被还原
C.反应中,CuFeS2既作氧化剂又作还原剂
D.当转移1 mol电子时,46 g CuFeS2参加反应
(4)下述反应中,若FeSO4和O2的系数比为2︰1,试配平下列方程式:
FeSO4 + K2O2 → K2FeO4 + K2O + K2SO4 + O2↑
(5)向某稀HNO3和Fe(NO3)3的混合溶液中逐渐加入铁粉,产生无色气体, 该气体遇空气变红棕色,溶液中Fe2+浓度和加入Fe粉的物质的量之间的关系如右图所示。则混合溶液中HNO3和Fe(NO3)3的物质的量浓度之比为__________。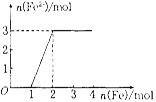
(6)某同学将铁与水蒸气高温反应后的固体物质溶解在过量盐酸中,如何判断所得溶液中是否含有Fe3+? ___________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某研究性学习小组对铝热反应实验展开研究。现行高中化学教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | -- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铝元素在自然界中主要存在于铝土矿(主要成分为Al2O3,还含有FeO、SiO2)中。工业上用铝土矿制备铝的某种化合物的工艺流程如下:
(1)滤液A所含溶质属于盐的是___________________。
(2)检验滤液B中是否还含有铁元素的方法为:_______________________________________
____________________________________________________________(注明试剂、现象)。
(3)将滤液B中的铝元素以沉淀形式析出,最佳试剂应选_____________(填代号)。
a.氢氧化钠溶液 b.硫酸溶液 c.氨水 d.二氧化碳
(4)SiO2和NaOH焙烧制备硅酸钠,可采用的装置为___________(填代号)。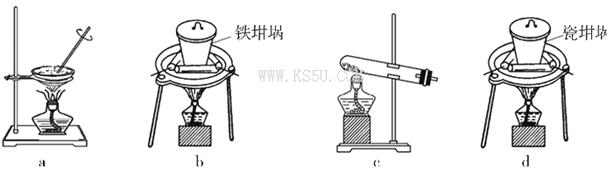
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
用含有A12O3、SiO2和少量FeO·xFe2O3的铝灰制备A12(SO4)3·18H2O,工艺流程如下(部分操作和条件略):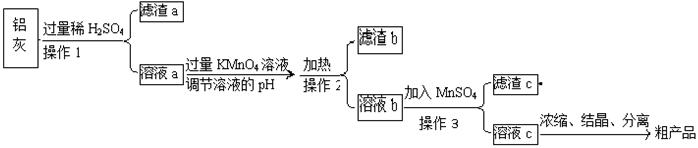
(1)滤渣a可用于制造 。
(2)请将MnO4-氧化Fe2+的离子方程式补充完整:
若反应中转移了2mol电子,则消耗氧化剂的物质的量为 mol。
(3)已知生成氢氧化物沉淀的pH如下:
| | Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
镁铝尖晶石(MgAl2O4)常做耐火材料。共沉淀制备尖晶石的方法是:用AlCl3和MgCl2的混合溶液(用a表示)与过量的氨水(用b表示)反应,再将得到的沉淀高温焙烧。完成下列填空:
(1)为使Mg2+、Al3+同时生成沉淀,应该把 (填“a”或“b”)滴入另一溶液中。
(2)将上述制备反应中部分元素的简单离子:Al3+、Cl–、Mg2+、H+、O2–按半径由大到小的顺序排列
(用离子符号表示)。
(3)AlCl3与氨水反应的反应物和生成物中,属于离子化合物的电子式是 ,属于难溶物的电离方程式 。
(4)不能说明氧元素的非金属性比氮元素强的事实是_________。
a. H2O比NH3稳定 b. 共用电子对偏向:H-O>H-N
c. 沸点:H2O>NH3 d. NO中氮是+2价,氧是-2价
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
.(本题16分)为验证氧化性:Cl2>Fe3+>SO2,某小组用下图所示装置进行实验(夹持仪器和甲中加热装置已略,气密性已检验)。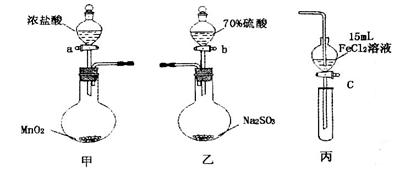
实验步骤:
1.在甲装置中,打开活塞a,加热,待装置中充满黄绿色气体时,与丙装置连接。
2.当丙装置中FeC12溶液变黄时,停止加热。
3.打开活塞c,使约2mL的溶液滴入试管中,检验溶液中的离子。
4.在乙装置中,打开活塞b,待空气排尽后,将乙中产生的气体通入上述丙装置变黄后的溶液中,一段时间后停止。
5.更新丙中试管,打开活塞c,使约2mL的溶液滴入试管中,检验溶液中的离子。
回答下列问题:
(1)甲中发生反应的化学方程式为___________________________________________。
(2)用70%的硫酸制取SO2,反应速率比用98%的硫酸快,原因是__________________。
(3)实验中,证明氧化性Fe3+>SO2的离子方程式为_____________________________。
(4)有I、II、III三组同学分别完成了上述实验,实验结果如下: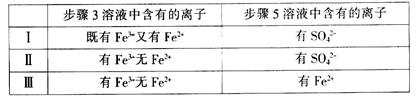
上述实验结果一定能够证明氧化性:Cl2>Fe3+>SO2的是___________(用“I”、“II”、“III”代号回答)。
(5)若要用以上甲和丙装置证明氧化性为:Cl2> Fe3+> I2的结论,则步骤为:
①往丙的漏斗中加入两种试剂_________、_________和一种溶剂__________。
②将甲装置中产生的Cl2慢慢通入丙中,观察丙的漏斗中溶液颜色变化。
③如果观察到丙中溶液_______________________________________则结论正确。
④停止通入Cl2。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com