
【题目】臭氧(![]() )能吸收紫外线,保护人类赖以生存的环境。
)能吸收紫外线,保护人类赖以生存的环境。![]() 分子的结构如图所示,呈
分子的结构如图所示,呈![]() 形,键角为
形,键角为![]() ,中间的一个氧原子与另外两个氧原子分别构成一个非极性共价键。中间氧原子提供2个电子,旁边两个氧原子各提供一个电子,构成一个特殊的化学键大
,中间的一个氧原子与另外两个氧原子分别构成一个非极性共价键。中间氧原子提供2个电子,旁边两个氧原子各提供一个电子,构成一个特殊的化学键大![]() 键(虚线内部分),分子中三个氧原子共用这4个电子。请回答:
键(虚线内部分),分子中三个氧原子共用这4个电子。请回答:
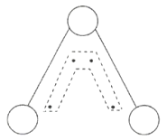
(1)![]() 中的非极性共价键是__________键。
中的非极性共价键是__________键。
(2)分子中的大![]() 键可用符号
键可用符号![]() 表示,其中m代表参与形成大
表示,其中m代表参与形成大![]() 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大![]() 键的电子数(如苯分子中的大
键的电子数(如苯分子中的大![]() 键可表示为
键可表示为![]() ),则
),则![]() 中的大
中的大![]() 键应表示为__________。
键应表示为__________。
(3)臭氧与氧气的关系是__________。
(4)下列物质的分子与![]() 分子的结构最相似的是__________(填序号)。
分子的结构最相似的是__________(填序号)。
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
【答案】![]()
![]() 互为同素异形体
互为同素异形体 ![]()
【解析】
(1)在臭氧O3中,中心的氧原子以sp2杂化,与两旁的配位氧原子键合生成两个σ键,
![]() 中的非极性共价键是σ键;
中的非极性共价键是σ键;
故答案为:σ;
(2)O3分子称折线形,在三个氧原子之间还存在着一个垂直于分子平面的大π键,分子中的大![]() 键可用符号
键可用符号![]() 表示,其中m代表参与形成大
表示,其中m代表参与形成大![]() 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大![]() 键的电子数(如苯分子中的大
键的电子数(如苯分子中的大![]() 键可表示为
键可表示为![]() ),则O3中的大
),则O3中的大![]() 键应表示为
键应表示为![]() ;
;
故答案为:![]() ;
;
(3)臭氧与氧气是氧元素形成的两种不同的单质,臭氧与氧气的关系是互为同素异形体。故答案为:互为同素异形体;
(4)等电子原理:原子数相同、电子总数相同的分子,互称为等电子体.等电子体的结构相似,O3中原子数为3、电子总数为24,
A.H2O中原子数为3、电子总数为10,故A不选;
B.CO2中原子数为3、电子总数为22,故B不选;
C.SO2中原子数为3、电子总数为24,故C选;
D.BeCl2中原子数为3、电子总数为38,故D不选,
故答案为:C。


科目:高中化学 来源: 题型:
【题目】辉铜矿主要成分为Cu2S,软锰矿主要成分为MnO2,它们都含有少量 SiO2、Fe2O3等杂质。工业上综合利用这两种矿物制备碳酸锰和硝酸铜晶体的主要工艺流程如图所示 :

已知:①部分金属阳离子生成氢氧化物沉淀的 pH范围如下表所示(开始沉淀的pH 按金属离子浓度为 0. l mol/L 计算)
开始沉淀的 pH | 沉淀完全的pH | |
Fe3+ | 1.1 | 3.2 |
Mn2+ | 8.3 | 9.8 |
Cu2+ | 4.4 | 6.4 |
②100.8≈6.3
(1)酸浸时,下列措施能够提高浸取速率的措施是__________________ 。
A.将矿石粉碎 B.适当延长酸浸时间 C.适当升高温度
(2)酸浸时, MnO2 与Cu2S反应的离子方程式是 __________________。
(3)浸出液调节pH = 4 的目的是_____________________ ,浸出液中铜离子浓度最大不能超过_______________ molL-1(保留一位小数)。
(4)生成 MnCO3 沉淀的离子方程式是_______________________。
(5)本工艺中可循环使用的物质是 ___________________(写化学式)。
(6)流程中需要加入过量HNO3溶液,除了使 Cu2(OH)2CO3完全溶解外,另一作用是蒸发结晶时_______________________。
(7)制得的Cu(NO3)2 晶体需要进一步纯化, 其实验操作名称是______________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:

回答下列问题:
(1)“酸浸”实验中,铁的浸出率结果如下图所示。由图可知,当铁的净出率为70%时,所采用的实验条件为___________________。

(2)“酸浸”后,钛主要以TiOCl42-形式存在,写出相应反应的离子方程式__________________。
(3)TiO2·xH2O沉淀与双氧水、氨水反应40 min所得实验结果如下表所示:
温度/℃ | 30 | 35 | 40 | 45 | 50 |
TiO2·xH2O转化率% | 92 | 95 | 97 | 93 | 88 |
分析40℃时TiO2·xH2O转化率最高的原因__________________。
(4)Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为__________________。
(5)若“滤液②”中c(Mg2+)=0.02 mol/L,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1×10-5 mol/L,此时是否有Mg3(PO4)2沉淀生成?___________(列式计算)。
FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-24。
(6)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
①存在阳离子的物质中一定存在阴离子
②金属元素原子和非金属元素原子之间一定形成离子键
③离子键的实质是阳离子、阴离子间的相互吸引
④根据电离方程式![]() ,可判断HCl分子中存在离子键
,可判断HCl分子中存在离子键
⑤某些离子化合物中含有共价键
A.仅①②⑤B.仅③C.仅③④D.仅⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年是“国际化学元素周期表年”。1869年门捷列夫把当时已知的元素根据物理、化学性质进行排列,准确预留了甲、乙两种未知元素的位置,并预测了二者的相对原子质量,部分原始记录如下所示。下列说法错误的是

A.甲位于现行元素周期表第四周期第ⅢA族
B.原子半径比较:甲>乙>Si
C.原子序数:甲-Ca=1
D.推测乙的单质可以用作半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1 mol某有机物在稀硫酸作用下,水解生成2 mol相同的物质。有下列物质:
①蔗糖 ②麦芽糖 ③淀粉 ④ ⑤
⑤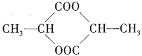
⑥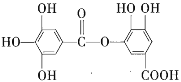 ⑦
⑦![]()
其中符合此题目要求的是( )
A.②⑤⑥⑦B.②④⑤⑦C.①②⑤⑦D.①④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取少量溴乙烷的装置如图所示,将生成物导入盛有冰水混合物的试管a中,实验结束发现试管a中的物质分为三层.对该实验的分析错误的是( )

A. 烧瓶中除发生取代反应可能发生消去反应、氧化还原反应等
B. 产物在a中第一层
C. a中有产物和水还含HBr、CH3CH2OH等
D. b中盛放的酸性KMnO4溶液会褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是
A. 除去乙醇中的少量水,方法是加入新制生石灰,经过滤后即得乙醇
B. HOCH2CH(CH3)2与(CH3)3COH属于碳链异构
C. 除去乙酸乙酯中的乙酸和乙醇杂质,可加入足量烧碱溶液,通过分液即得乙酸乙酯
D. 一个苯环上已经连有-CH3、-CH2CH3、-OH三种基团,如果在苯环上再连接一个-CH3,其同分异构体有16种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10 mL 0.1 mol/L的HR溶液中逐滴滴入0.l mol/L 的氨水,溶液pH及导电性变化如图。

下列分析正确的是
A.HR为强酸
B.加入10 mL 氨水时,溶液中c(NH4+)>c(R-)
C.c点溶液存在c(NH4+)<c( R-)
D.b点的离子浓度大于a点的离子浓度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com