
【题目】1 mol某有机物在稀硫酸作用下,水解生成2 mol相同的物质。有下列物质:
①蔗糖 ②麦芽糖 ③淀粉 ④ ⑤
⑤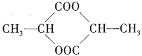
⑥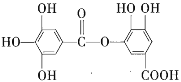 ⑦
⑦![]()
其中符合此题目要求的是( )
A.②⑤⑥⑦B.②④⑤⑦C.①②⑤⑦D.①④⑤⑥
科目:高中化学 来源: 题型:
【题目】相同温度、相同容积的四个密闭容器中进行同样的可逆反应:2X(g)+Y(g)![]() 3W(g)+2Z(g) △H=﹣Q KJ/mol,起始时充入气体的物质的量及平衡时体系能量变化数据如表,下列说法正确的是( )
3W(g)+2Z(g) △H=﹣Q KJ/mol,起始时充入气体的物质的量及平衡时体系能量变化数据如表,下列说法正确的是( )
X | Y | W | Z | 反应体系能量变化 | |
甲 | 2mol | 1mol | 放出a kJ/mol | ||
乙 | 1mol | 1mol | 放出b kJ/mol | ||
丙 | 2mol | 2mol | 放出c kJ/mol | ||
丁 | 3mol | 2mol | 吸收d kJ/mol |
A.X的转化率为:甲<乙<丙
B.c+d<Q
C.平衡时,甲容器中的反应速率比丁容器中的慢
D.平衡时丙容器中Z的物质的量浓度最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
钾和碘的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)元素K的焰色反应呈紫红色,其中紫色对应的辐射波长为_______nm(填标号)。
A.404.4 B.553.5 C.589.2 D.670.8 E.766.5
(2)基态K原子中,核外电子占据的最高能层的符号是_________,占据该能层电子的电子云轮廓图形状为___________。K和Cr属于同一周期,且核外最外层电子构型相同,但金属K的熔点、沸点等都比金属Cr低,原因是___________________________。
(3)X射线衍射测定等发现,I3AsF6中存在I3+离子。I3+离子的几何构型为_____________,中心原子的杂化形式为________________。
(4)KIO3晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立体结构,边长为a=0.446nm,晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示。K与O间的最短距离为______nm,与K紧邻的O个数为__________。
(5)在KIO3晶胞结构的另一种表示中,I处于各顶角位置,则K处于______位置,O处于______位置。
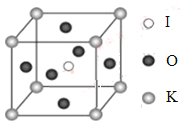
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配位键是一种特殊的化学键,其中共用电子对由某原子单方面提供。如![]() 就是由
就是由![]() (氮原子提供共用电子对)和
(氮原子提供共用电子对)和![]() (缺电子)通过配位键形成的。据此回答下列问题。
(缺电子)通过配位键形成的。据此回答下列问题。
(1)下列粒子中存在配位键的是__________(填序号)
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
(2)硼酸(![]() )溶液呈酸性,试写出其电离方程式:____________________。
)溶液呈酸性,试写出其电离方程式:____________________。
(3)科学家对![]() 结构的认识经历了较为漫长的过程,最初科学家提出了两种观点:
结构的认识经历了较为漫长的过程,最初科学家提出了两种观点:
甲: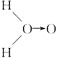 (式中O→O表示配位键,在化学反应中O→O键遇到还原剂时易断裂)
(式中O→O表示配位键,在化学反应中O→O键遇到还原剂时易断裂)
乙:HOOH
化学家Baeyer和Villiyer为研究H2O2的结构,设计并完成了下列实验:
a.将C2H5OH与浓H2SO4反应生成(C2H5)2SO4和水;
b.将制得的(C2H5)2SO4与H2O2反应,只生成A和H2SO4;
c.将生成的A与H2反应(已知该反应中H2作还原剂)。
①如果H2O2的结构如甲所示,实验c中化学反应方程式为(A写结构简式)________________。
②为了进一步确定H2O2的结构,还需要在实验c后添加一步实验d,请设计d的实验方案:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧(![]() )能吸收紫外线,保护人类赖以生存的环境。
)能吸收紫外线,保护人类赖以生存的环境。![]() 分子的结构如图所示,呈
分子的结构如图所示,呈![]() 形,键角为
形,键角为![]() ,中间的一个氧原子与另外两个氧原子分别构成一个非极性共价键。中间氧原子提供2个电子,旁边两个氧原子各提供一个电子,构成一个特殊的化学键大
,中间的一个氧原子与另外两个氧原子分别构成一个非极性共价键。中间氧原子提供2个电子,旁边两个氧原子各提供一个电子,构成一个特殊的化学键大![]() 键(虚线内部分),分子中三个氧原子共用这4个电子。请回答:
键(虚线内部分),分子中三个氧原子共用这4个电子。请回答:
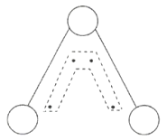
(1)![]() 中的非极性共价键是__________键。
中的非极性共价键是__________键。
(2)分子中的大![]() 键可用符号
键可用符号![]() 表示,其中m代表参与形成大
表示,其中m代表参与形成大![]() 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大![]() 键的电子数(如苯分子中的大
键的电子数(如苯分子中的大![]() 键可表示为
键可表示为![]() ),则
),则![]() 中的大
中的大![]() 键应表示为__________。
键应表示为__________。
(3)臭氧与氧气的关系是__________。
(4)下列物质的分子与![]() 分子的结构最相似的是__________(填序号)。
分子的结构最相似的是__________(填序号)。
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由人体尿液分离出来的结晶化合物A,熔点为187~188℃。现对化合物A进行如下实验:
(1)A的蒸气密度为8.0 g/L (已折合成标准状况)。取17.90 g A完全燃烧,将生成的气体先通过浓硫酸,浓硫酸质量增加8.10 g,再将剩余气体通过碱石灰,气体质量减轻39.60 g;另取17.90 g A使其完全分解,可得到1.12 L (标准状况)氮气。则A的分子式为_________________。
(2)A和足量6 mol/L的盐酸混合加热可以完全水解,1 mol A水解可生成1 mol B和1 mol C。已知:A、B、C三种物质的分子中均含有一个羧基;B仅由碳、氢、氧三种元素组成,三种元素原子的物质的量之比为7∶6∶2;C的名称为甘氨酸。试写出A的结构简式:_____________,B的分子式:_________,C的一种同分异构体的结构简式:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T1时,在三个容积均为1 L的恒容密闭容器中仅发生反应 2NO2(g)2NO(g)+O2(g) ΔH>0。实验测得:υ正=υ(NO2)消耗=k正c2(NO2),υ逆=υ(NO)消耗=2υ(O2)消耗=k逆c2(NO)·c(O2),k正、k逆为速率常数,受温度影响。下列说法正确的是( )
容器编号 | 物质的起始浓度(mol·L-1) | 物质的平衡浓度(mol·L-1) | ||
c(NO2) | c(NO) | c(O2) | c(O2) | |
Ⅰ | 0.6 | 0 | 0 | 0.2 |
Ⅱ | 0.3 | 0.5 | 0.2 | |
Ⅲ | 0 | 0.5 | 0.35 | |
A.反应达平衡时,容器Ⅰ与容器Ⅱ中的总压强之比为1∶1
B.反应达平衡时,容器Ⅱ中![]() 比容器Ⅰ中的大
比容器Ⅰ中的大
C.反应达平衡时,容器Ⅲ中NO的体积分数大于50%
D.当温度改变为T2时,若k正=k逆,则T2>T1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为1 L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
(1)反应的ΔH_____0(填“大于”或“小于”);100 ℃时,体系中各物质浓度随时间变化如图所示。在 0~60 s 时段, 反应速率 v(N2O4)为_____mol·L-1·s-1;反应的平衡转化率为:_____; 反应的平衡常数K1为_____。

(2)100℃时达平衡后,改变反应温度为 T,N2O4以0.002 0 mol·L-1·s-1的平均速率降低,经10 s又达到平衡。
a:T____________100℃(填“大于”或“小于”),判断理由是__________。
b:计算温度T时反应的平衡常数K2____________。
(3)温度T时反应达平衡后,将反应容器的容积减少一半。平衡向____________(填“正反应”或“逆反应”)方向移动,判断理由________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】辉钼精矿主要成分是二氧化钼(MoS2),还含有石灰石、石英、黄铜矿(CuFeS2)等杂质。某学习小组设计提取MoS2的过程如下:下列说法错误的是

A.为加快辉钼精矿溶解,可将矿石粉粹并适当加热
B.加滤液中含Ca2+、Fe2+、Fe3+、Cu2+、H+等离子
C.以上①②③过程均涉及氧化还原反应
D.步骤③温度不宜过高,以免MoS2被氧化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com