
X(g)+2Y(s)  2Z(g) △H=-akJ/mol,一定条件下,将1molX和2molY加入2L的恒容密闭容器中,10min后测得Y的物质的量为1.4mol。下列说法正确的是
2Z(g) △H=-akJ/mol,一定条件下,将1molX和2molY加入2L的恒容密闭容器中,10min后测得Y的物质的量为1.4mol。下列说法正确的是
A. 10min内,X的平均反应速率为0.03mol/(L·min)
B. 若容器中的气体密度不再发生变化,说明上述反应已达平衡状态
C. 10min后Z的浓度为0.7mol/L
D. 10min内,反应放出的热量为0.3kJ
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016-2017学年江西省南昌市高二上学期期末考试化学试卷(解析版) 题型:选择题
下列烷烃在光照下与氯气反应,只生成一种一氯代烃的是
A. CH3CH2CH2CH3 B. CH3CH(CH3)2
C. CH3C(CH3)3 D. (CH3)2CHCH2CH3
查看答案和解析>>
科目:高中化学 来源:2017届江苏省、溧水高级中学)等六校高三2月联考化学试卷(解析版) 题型:选择题
以N2和H2为反应物、溶有A的稀盐酸为电解质溶液,可制成能固氮的新型燃料电池,原理如下图所示。下列说法错误的是
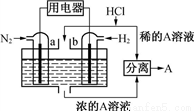
A. b电极为负极,发生氧化反应
B. a电极发生的反应为N2+8H++6e-=2NH4+
C. A溶液中所含溶质为NH4Cl
D. 当反应消耗1mol N2时,则消耗的H2为67.2L
查看答案和解析>>
科目:高中化学 来源:2017届浙江省台州市高三上学期期末质量评估考试化学试卷(解析版) 题型:选择题
已知C2H2在氧气充足时燃烧生成CO2,不足时生成CO,严重不足时生成碳。现将amolC2H2与bmolO2混合后在密闭容器中用电火花点燃。下列说法不正确的是
A. 若a≥2b,发生的反应化学方程式为:2C2H2+O2=4C+2H2O
B. 若(2/5)b<a<(2/3)b,燃烧后在密闭容器中加入含amolCa(OH)2的石灰水,发生反应的离子方程式为:OH-+CO2=HCO3-
C. 若a<(2/5)b,燃烧过程中转移的电子的物质的量为10amol
D. 若a=(1/2)b,燃烧产物既有CO2又有CO,且n(CO2):n(CO)=1
查看答案和解析>>
科目:高中化学 来源:2017届浙江省台州市高三上学期期末质量评估考试化学试卷(解析版) 题型:选择题
氢氧燃料电池是一种化学电源,如图所示,以石墨为电极,两极分别通入氢气和氧气,KOH溶液为电解质溶液,下列说法不正确的是
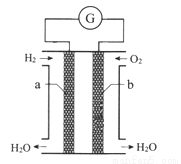
A. a电极是该电池的正极
B. 电池工作时,电子从a电极流出经导线流向b电极
C. 工作一段时间后,电解质溶液碱性减弱
D. b极的电极反应式为:O2+2H2O+4e-=4OH-
查看答案和解析>>
科目:高中化学 来源:2017届浙江省台州市高三上学期期末质量评估考试化学试卷(解析版) 题型:选择题
下列化学用语表示正确的是
A. 乙炔的结构简式:CHCH B. OH-的电子式:
C. F-的结构示意图: D. CCl4的比例模型:
D. CCl4的比例模型:
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三下学期开学考试化学试卷(解析版) 题型:简答题
铜元素的化合物种类很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们。
(1)CuSO4和Cu(NO3)2是自然界中重要的铜盐。
① CuSO4和Cu(NO3)2中阳离子的基态外围电子排布式为_______________。
② S、O、N三种元素的第一电离能由大到小为_____________。
③ CuSO4的熔点为560℃,Cu(NO3)2的熔点为115℃,CuSO4熔点更高的原因是________。
(2)硫酸铜溶液中滴入氨基乙酸钠(H2NCH2COONa)即可得到配合物A,其结构如图所示。请回答下列问题:
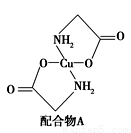
① 配合物A中N原子的轨道杂化类型为__________。
② 1 mol配合物A含有σ键的数目为_____________。
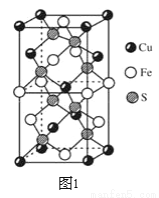
(3)CuFeS2的晶胞如图1所示,CuFeS2的晶胞中每个Cu原子与__个S原子相连
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三下学期开学考试化学试卷(解析版) 题型:选择题
W、X、Y、Z均为的短周期元素,原子序数依次增加,W的原子核外最外层电子数是次外层的2倍,X-、Y+具有相同的电子层结构,Z的阴离子不能发生水解反应。下列说法正确的是
A. 原子半径:Y>Z>X>W
B. 简单氢化物的熔沸点:Z>X>W
C. X与Y两种元素组成的化合物是离子化合物
D. 最高价氧化物的水化物的酸性:W <Z<X
查看答案和解析>>
科目:高中化学 来源:2017届山东省菏泽市高三上学期期末学分认定考试B卷化学试卷(解析版) 题型:简答题
化学反应原理揭示了不同的物质在水溶液中有不同的行为。请按要求回答下列问题:(已知:H2SO3: Ka1=1.7×10-2,Ka2=6.0×10-8 ; NH3·H2O:Kb=1.8×10-5)
(1)将等物质的量的SO2与NH3溶于水充分反应,所得溶液呈_________性,该溶液中各离子浓度由大到小的顺序为:_______________,所得溶液中c(H+)-c(OH-)=_______________(填写表达式)
(2)用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如下图所示(电极材料为石墨)。

①图中a极要连接电源的(填“正”或“负”)________极;C口流出的物质是________。
②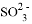 放电的电极反应式为_______________。
放电的电极反应式为_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com