

图3-4
A.增大 B.不变 C.减小 D.无法判断
科目:高中化学 来源: 题型:阅读理解
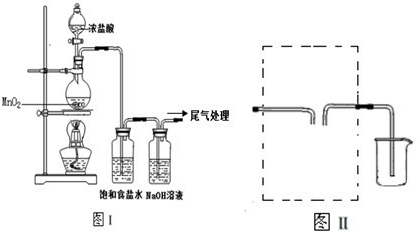
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
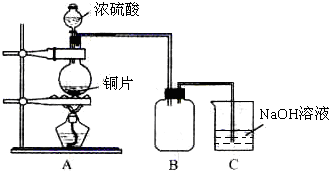
查看答案和解析>>
科目:高中化学 来源:高考三人行 化学 题型:022
(1)在一盛有氢氧化钡溶液的烧杯中漂浮着一小木块.小心地向烧杯中滴加与氢氧化钡溶液密度相同的稀硫酸,静置后小木块浸入水中的体积比开始
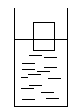
[ ]
(2)写出发生的反应的离子方程式________.
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
2CNO-+3ClO-+2 H+====N2↑+2CO2↑+3Cl-+H2O。某科研部门用图1-5-25所示装置进行模拟实验,以证明上述处理CN-污水方法的有效性,并测定CN-被处理的百分率,下述实验装置通过测定CO2的量来确定CN-的处理效果。
试根据要求完成下列问题:
(1)将浓缩后含CN-的污水(其中CN-浓度为0.50 mol·L-1)20 mL倒入甲装置中,再向甲装置中加入过量的漂白粉溶液,塞上橡皮塞,一段时间后,打开活塞,使溶液全部进入乙中,关闭活塞。乙装置中生成的气体除含有CO2、N2、HCl外,还有副反应生成的Cl2等物质,写出生成Cl2的副反应的离子方程式:_____________________________________________。
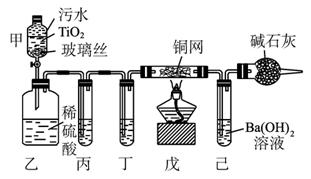
图1-5-25
(2)丙中加入的除杂试剂是_________,丁中的试剂是_________。
A.饱和碳酸氢钠溶液 B.饱和食盐水
C.浓硫酸 D.饱和碳酸钠溶液
(3)戊在实验中的作用是______________________________________________________
____________________________________________________________________。
(4)若己中盛有足量氢氧化钡,实验后己中共生成1.773 g沉淀,则该实验中CN-被处理的百分率为_________ (Ba的相对原子质量为137)。
(5)若己中盛有的氢氧化钡溶液为10 mL,要使CN-完全被氧化,氢氧化钡的物质的量浓度最低为_________ (保留1位小数)。
(6)上述实验中造成戊中碳酸钡质量测定值偏小的可能原因有(写出两点即可) ____________
_____________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com