
【题目】氮氧化物是形成光化学烟雾和酸雨的重要原因。人们研究了诸多有关氮氧化物的性质,请回答下列问题:
(1)处理NOx的一种方法是利用甲烷催化还原NOx。
CH4(g)+4NO2(g) = 4NO(g)+CO2(g)+2H2O(g) K1
CH4 (g)+2NO2(g) = N2 (g)+CO2(g)+2H2O(g) K2
CH4 (g)+4NO(g) = 2N2 (g)+CO2(g)+2H2O(g) K3
K1、K2、K3依次为三个反应的平衡常数,则K3=____________(用K1、K2表示)
(2)在恒容密闭容器中通入等物质的量的CO和NO,在一定条件下发生反应:2CO(g)+2NO(g)![]() N2(g)+2CO2 (g),测得NO的平衡转化率与温度及压强的关系如图所示:
N2(g)+2CO2 (g),测得NO的平衡转化率与温度及压强的关系如图所示:

①则该反应的△H ________0(填“﹤”“﹥”或“=”)。
②对于气相反应,用某组分(B)的平衡分压强 p(B)代替物质的量浓度 c(B) 也可表示平衡常数kp,如果p1 =1.65MPa,求a点的平衡常数kp =_________(MPa)1 (结果保留 3 位有效数字,分压=总压×物质的量分数)。
(3)利用电化学原理,将NO2、O2和熔融的KNO3制成燃料电池,模拟工业电解法来处理含Cr2O72的废水,如图所示;电解过程中溶液发生反应:Cr2O72+6Fe2++14H+=2Cr3++6Fe3+ +7H2O。

①甲电池工作时,Y是气体,可循环使用。则石墨I附近发生的电极反应式为________。乙池中的pH________(填“变大”“变小”或“不变”)。
②工作时,在相同条件下,甲池内消耗的O2和NO2的体积比为____________。
(4)已知H3PO4为三元酸,Ka1=7.0×103mol·L1,Ka2=6.2×108 mol·L1,Ka3=4.5×1013mol·L 1。则 Na2HPO4水溶液呈________(填“酸”、“中”、“碱”)性,用Ka与Kh的相对大小,说明判断理由_____。
【答案】![]() ﹤ 21.2(MPa)-1 NO2+NO3—-e-=N2O5 变大 1:4 碱 Kh=KW/Ka2=1.6×10-7mol-1>Ka3,HPO42-的水解程度大于电离程度,故而显碱性
﹤ 21.2(MPa)-1 NO2+NO3—-e-=N2O5 变大 1:4 碱 Kh=KW/Ka2=1.6×10-7mol-1>Ka3,HPO42-的水解程度大于电离程度,故而显碱性
【解析】
(1)设CH4(g)+4NO2(g) = 4NO(g)+CO2(g)+2H2O(g)为①式,CH4 (g)+2NO2(g) = N2 (g)+CO2(g)+2H2O(g)为②式,CH4 (g)+4NO(g) = 2N2 (g)+CO2(g)+2H2O(g)为③式,可知③=②×2-①,故![]() ;
;
(2)①选取任意一条等压线,发现温度越高,NO的平衡转化率越小,即升高温度,平衡逆向移动,故正反应放热,即该反应的△H<0;
②假设反应前投入CO和NO的浓度2amol,可列出

平衡时,CO的物质的量分数为![]() ,NO的物质的量分数为
,NO的物质的量分数为![]() ,氮气的物质的量分数为
,氮气的物质的量分数为![]() ,二氧化碳的物质的量分数为
,二氧化碳的物质的量分数为![]() ,则
,则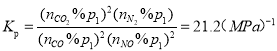 ;
;
(3)Y为N2O5,石墨I为原电池的负极,石墨II为原电池的正极,则Fe(I)为电解池的阳极,Fe(II)为电解池的阴极;
①石墨I附近发生的电极反应式为NO2+NO3—-e-=N2O5,乙池中氢离子放电,导致pH增大;
②因为石墨Ⅰ为负极,原电池中阴离子向负极移动,根据得失电子守恒计算![]() 反应中转移4mol电子,
反应中转移4mol电子,![]() 转变成
转变成![]() ,转移4mol电子,相同状况下气体的体积比等于物质的量之比,故
,转移4mol电子,相同状况下气体的体积比等于物质的量之比,故![]() 和
和![]() 的体积比为1:4;
的体积比为1:4;
(4)Na2HPO4的水解常数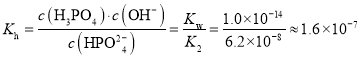 ,HPO42-的电离平衡常数为Ka3=4.5×1013mol·L 1,即HPO42-的水解程度大于其电离程度,因而pH<7。
,HPO42-的电离平衡常数为Ka3=4.5×1013mol·L 1,即HPO42-的水解程度大于其电离程度,因而pH<7。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】硼氢化钠(NaBH4)为白色粉末,熔点400℃,容易吸水潮解,可溶于异丙胺(熔点:-101℃,沸点:33℃),在干燥空气中稳定,吸湿而分解,是无机合成和有机合成中常用的选择性还原剂。某研究小组采用偏硼酸钠(NaBO2)为主要原料制备NaBH4,其流程如图:下列说法不正确的是( )
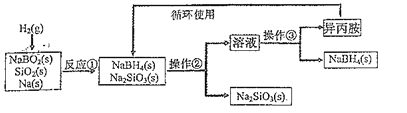
A.NaBH4中H元素显+1价
B.操作③所进行的分离操作是蒸馏
C.反应①为NaBO2+SiO2+4Na+2H2═NaBH4+2Na2SiO3
D.实验室中取用少量钠需要用到的实验用品有镊子、滤纸、玻璃片和小刀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,pH=1的某溶液中还含有 Na+、Fe3+、Fe2+、I-、Cl-、CO32-中的若干种,现取100mL 该溶液进行实验(不考虑实验操作过程中物质质量的损失,忽略溶液体积变化):①向该溶液中通入过量氯气,充分反应后加入CCl4进行萃取分液,得到水层和紫色有机层;②向实验①得到的水层,加入足量的NaOH溶液,产生沉淀,过滤,得到的沉淀进行洗涤、灼烧后得到1.60g固体;③向实验②所得滤液中加入硝酸银溶液和稀硝酸,产生白色沉淀;④向实验①所得到的紫色有机层,进行一系列操作后,得到2.54g紫黑色固体。根据实验结果,下列判断正确的是
A.不能确定Na+和Cl-是否存在,CO32-一定不存在
B.Fe2+、I-、Cl-三种离子一定存在
C.Fe3+、Fe2+至少有一种
D.该溶液中c(Cl-)≥0.1mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各图的叙述,正确的是
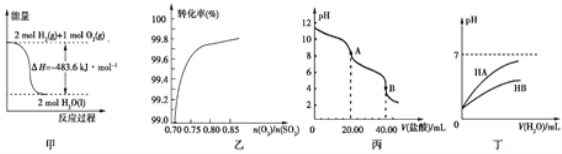
A. 图甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为483.6 kJ·mol-1
B. 图乙表示反应2SO2(g)+O2(g)![]() 2SO3(g)在其他条件不变时,O2的转化率随
2SO3(g)在其他条件不变时,O2的转化率随![]() 的变化关系
的变化关系
C. 图丙表示用0.100 0 mol·L-1的盐酸滴定20.00 mL 0.100 0 mol·L-1Na2CO3溶液的曲线,从A点到B点反应的离子方程式为:CO32-+2H+![]() CO2↑+H2O
CO2↑+H2O
D. 图丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液的pH随加水量的变化,则同浓度溶液的pH:NaA<NaB
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料,在催化剂作用下可发生反应:2SiHCl3(g)![]() SiH2Cl2(g)+SiCl4(g),在50 ℃和70 ℃ K时SiHCl3的转化率随时间变化的结果如图所示。
SiH2Cl2(g)+SiCl4(g),在50 ℃和70 ℃ K时SiHCl3的转化率随时间变化的结果如图所示。

下列叙述不正确的是
A.该反应为吸热反应
B.反应速率大小:va >vb
C.70 ℃时,平衡常数K =0.112/0.782
D.增大压强,可以提高SiHCl3的平衡转化率,缩短达平衡的时间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某密闭容器中充入1mol N2和3molH2,一定条件下发生反应N2(g) + 3H2(g) ![]() 2NH3(g),达到化学平衡时,下列说法正确的是( )
2NH3(g),达到化学平衡时,下列说法正确的是( )
A.反应停止了B.正逆反应速率相等
C.N2的浓度为0D.H2的转化率为100%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.欲配制0.18 mol·L-1醋酸钠溶液500 mL,可采用以下两种方案;
方案一:用托盘天平称取________g无水醋酸钠,溶于适量水中,配成500 mL溶液。定容时若仰视容量瓶刻度线,则所配制结果将___________(填“偏大”“偏小”或“无影响”)。
方案二:用体积均为250 mL且浓度均为________ mol·L-1的醋酸与氢氧化钠两溶液混合而成(设混合后的体积等于混合前两者体积之和)。
Ⅱ.某些非金属单质可以与强碱溶液发生反应。例如白磷(P4)可以与过量的热NaOH溶液反应生成PH3气体和NaH2PO2(次磷酸钠)。
(1)写出上述反应的化学方程式______________________________
(2) NaH2PO2 为__________ (填“正盐”或“酸式盐”),
(3)已知NaH2PO2水溶液pH>7,次磷酸的电离方程式为______________________;
NaH2PO2水溶液pH>7的原因:________________________________________。
(4)H3PO2 及 NaH2PO2均可将溶液中的 Ag+ 还原为银,从而可用于化学镀银。
利用(H3PO2)进行化学镀银反应中,氧化剂与还原剂的物质的量之比为 4︰1,则氧化产物为:
______________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根皮素R( )可应用于面膜、护肤膏霜和精华素中。其中一种合成R的路线如下:
)可应用于面膜、护肤膏霜和精华素中。其中一种合成R的路线如下:

已知
①
② +R’’CHO
+R’’CHO +H2O
+H2O
(1)A的化学名称是___________,B→C的反应类型是___________。
(2)D的结构简式是___________,其核磁共振氢谱共有___________组峰。
(3)E→F的化学方程式为___________,G的官能团的名称是___________。
(4)G→H的化学方程式为______________________。
(5)M是F的同分异构体,同时符合下列条件的M的结构有___________种(不考虑立体异构)
①1能与FeCl3溶液发生显色反应 ②能发生银镜反应
(6)设计以丙烯和1,3-丙二醛为起始原料制备![]() 的合成路线___________(无机试剂任选)。
的合成路线___________(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷作为一种新能源在化学领域应用广泛,请回答下列问题。
(1)高炉冶铁过程中,甲烷在催化反应室中产生水煤气(CO和H2)还原氧化铁,有关反应为:CH4(g)+CO2(g)===2CO(g)+2H2(g) ΔH=260 kJ·mol-1
已知:2CO(g)+O2(g)===2CO2(g)
ΔH=-566 kJ·mol-1。
则CH4与O2反应生成CO和H2的热化学方程式为_________________________________。
(2)如下图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。

①a处应通入________(填“CH4”或“O2”),b处电极上发生的电极反应式是__________________________________。
②电镀结束后,装置Ⅰ中溶液的pH________(填写“变大”“变小”或“不变”,下同),装置Ⅱ中Cu2+的物质的量浓度________。
③电镀结束后,装置Ⅰ溶液中的阴离子除了OH-以外还含有________(忽略水解)。
④在此过程中若完全反应,装置Ⅱ中阴极质量变化12.8 g,则装置Ⅰ中理论上消耗甲烷________L(标准状况下)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com