
【题目】25℃时,向20mL0.1mol·L-1H3PO2溶液中滴加0.1mol·L-1的NaOH溶液,滴定曲线如图1,含磷微粒物质的量浓度所占分数(δ)随pH变化关系如图2。下列说法不正确是
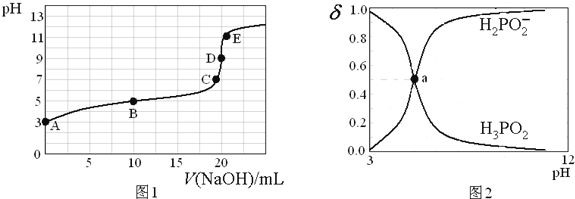
A. H3PO2的电离方程式为H3PO2![]() H2PO2-+H+ Ka≈10-5
H2PO2-+H+ Ka≈10-5
B. B点时,溶液中存在关系:2c(H+)+c(H2PO2-)=2c(OH-)+c(H3PO2)
C. C点时,溶液中存在关系:c(Na+)+c(H+)=C(H2PO2-)+c(OH-)
D. D点时,溶液中微粒浓度大小关系:c(Na+)>c(H2PO2-)>c(OH-)>c(H+)
 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:
【题目】下列原子半径大小顺序正确的是( )
①1s22s22p3 ②1s22s22p63s23p3③1s22s22p5 ④1s22s22p63s23p2
A. ③>④>②>①B. ④>③>②>①
C. ④>③>①>②D. ④>②>①>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D为气体,其中A为黄绿色气体。E、F为固体且均含三种元素,G是氯化钙,它们之间的转换关系如下图所示:

(1)D的化学式是__________________________。
(2)H的电子式为__________________________。
(3)A和B反应生成C的化学方程式是__________________________。
(4)将A通入F的澄清溶液中所发生反应的离子方程式是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物W可用作高分子膨胀剂,一种合成路线如下:

回答下列问题:
(1)A的化学名称为________。
(2)②的反应类型是__________。
(3)反应④所需试剂,条件分别为________。
(4)G的分子式为________。
(5)W中含氧官能团的名称是____________。
(6)写出与E互为同分异构体的酯类化合物的结构简式(核磁共振氢谱为两组峰,峰面积比为1∶1)______________。
(7)苯乙酸苄酯( )是花香型香料,设计由苯甲醇为起始原料制备苯乙酸苄酯的合成路线__________(无机试剂任选)。
)是花香型香料,设计由苯甲醇为起始原料制备苯乙酸苄酯的合成路线__________(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】AlPO4的沉淀溶解平衡曲线如图所示(T2>T1).下列说法正确的是( )

A. 图象中四个点的Ksp:a=b>c>d
B. AlPO4在b点对应的溶解度大于c点
C. AlPO4(s)Al3+(aq)+PO43-(aq)△H<0
D. 升高温度可使d点移动到b点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在硝酸铝和硝酸镁的混合溶液中,逐滴加入稀氢氧化钠溶液,直至过量。下列表示氢氧化钠加入量(X)与溶液中沉淀物的量(Y)的关系示意图中正确的是( )
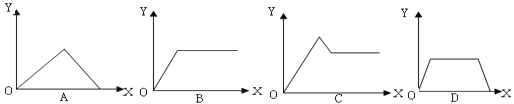
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是一种廉价的碳资源,其综合利用具有重要意义。回答下列问题:
(1)CO2可以被NaOH溶液捕获。若所得溶液pH=13,CO2主要转化为______(写离子符号);若所得溶液c(HCO3)∶c(CO32)=2∶1,溶液pH=___________。(室温下,H2CO3的K1=4×107;K2=5×1011)
(2)CO2与CH4经催化重整,制得合成气:
CH4(g)+ CO2(g) ![]() 2CO (g)+ 2H2(g)
2CO (g)+ 2H2(g)
①已知上述反应中相关的化学键键能数据如下:
化学键 | C—H | C=O | H—H | C |
键能/kJ·mol1 | 413 | 745 | 436 | 1075 |
则该反应的ΔH=_________。分别在VL恒温密闭容器A(恒容)、B(恒压,容积可变)中,加入CH4和CO2各1 mol的混合气体。两容器中反应达平衡后放出或吸收的热量较多的是_______(填“A” 或“B ”)。
②按一定体积比加入CH4和CO2,在恒压下发生反应,温度对CO和H2产率的影响如图3所示。此反应优选温度为900℃的原因是________。
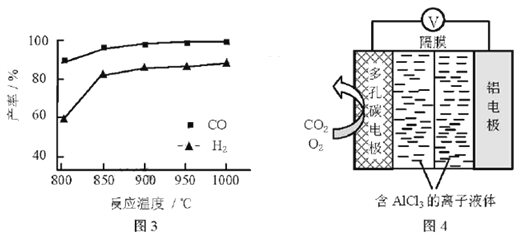
(3)O2辅助的Al~CO2电池工作原理如图4所示。该电池电容量大,能有效利用CO2,电池反应产物Al2(C2O4)3是重要的化工原料。
电池的负极反应式:________。
电池的正极反应式:6O2+6e![]() 6O2
6O2
6CO2+6O2![]() 3C2O42
3C2O42
反应过程中O2的作用是________。
该电池的总反应式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验室由Al盐制备Al(OH)3最佳选择NH3·H2O,其离子反应方程式:____________________________
(2)12.4g Na2X含有0.4mol Na+, Na2X的摩尔质量为________。
(3)由氨气和氢气组成的混合气体的平均相对分子质量为12,则氨气和氢气的物质的量之比为_________
(4)已知![]() 离子可与R2-离子反应,R2-被氧化为R单质,
离子可与R2-离子反应,R2-被氧化为R单质,![]() 的还原产物中M为+3价;又已知100mL c(
的还原产物中M为+3价;又已知100mL c(![]() )=0.2 mol·L-1的溶液可与100mL c(R2-)=0.6 mol·L-1的溶液恰好完全反应,则n值为__________
)=0.2 mol·L-1的溶液可与100mL c(R2-)=0.6 mol·L-1的溶液恰好完全反应,则n值为__________
A.4B.5C.6D.7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“纳米材料”是当今材料科学研究的前沿,其研究成果广泛应用于催化及军事科学中。“纳米材料”是指研究、开发出的直径从几纳米至几十纳米的材料。如将“纳米材料”分散到液体分散剂中,所得混合物可能具有的性质是
A.所得分散系不稳定B.能全部透过半透膜
C.不能透过滤纸D.有丁达尔效应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com