
【题目】CO2是一种廉价的碳资源,其综合利用具有重要意义。回答下列问题:
(1)CO2可以被NaOH溶液捕获。若所得溶液pH=13,CO2主要转化为______(写离子符号);若所得溶液c(HCO3)∶c(CO32)=2∶1,溶液pH=___________。(室温下,H2CO3的K1=4×107;K2=5×1011)
(2)CO2与CH4经催化重整,制得合成气:
CH4(g)+ CO2(g) ![]() 2CO (g)+ 2H2(g)
2CO (g)+ 2H2(g)
①已知上述反应中相关的化学键键能数据如下:
化学键 | C—H | C=O | H—H | C |
键能/kJ·mol1 | 413 | 745 | 436 | 1075 |
则该反应的ΔH=_________。分别在VL恒温密闭容器A(恒容)、B(恒压,容积可变)中,加入CH4和CO2各1 mol的混合气体。两容器中反应达平衡后放出或吸收的热量较多的是_______(填“A” 或“B ”)。
②按一定体积比加入CH4和CO2,在恒压下发生反应,温度对CO和H2产率的影响如图3所示。此反应优选温度为900℃的原因是________。
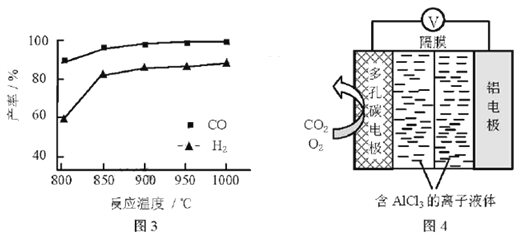
(3)O2辅助的Al~CO2电池工作原理如图4所示。该电池电容量大,能有效利用CO2,电池反应产物Al2(C2O4)3是重要的化工原料。
电池的负极反应式:________。
电池的正极反应式:6O2+6e![]() 6O2
6O2
6CO2+6O2![]() 3C2O42
3C2O42
反应过程中O2的作用是________。
该电池的总反应式:________。
【答案】 CO32- 10 +120 kJ·mol-1 B 900 ℃时,合成气产率已经较高,再升高温度产率增幅不大,但能耗升高,经济效益降低。 Al–3e–=Al3+(或2Al–6e–=2Al3+) 催化剂 2Al+6CO2=Al2(C2O4)3
【解析】分析:本题考查的是化学反应原理的综合应用,主要包括反应与能量以及化学反应速率、平衡的相关内容。只需要根据题目要求,利用平衡速率的方法进行计算即可。
详解:(1)CO2可以被NaOH溶液捕获。若所得溶液pH=13,因为得到溶液的碱性较强,所以CO2主要转化为碳酸根离子(CO32-)。若所得溶液c(HCO3)∶c(CO32)=2∶1,,则根据第二步电离平衡常数K2=![]() =5×1011,所以氢离子浓度为1×10-10mol/L,pH=10。
=5×1011,所以氢离子浓度为1×10-10mol/L,pH=10。
(2)①化学反应的焓变应该等于反应物键能减去生成物的键能,所以焓变为(4×413+2×745)-(2×1075+2×436)= +120 kJ·mol-1。初始时容器A、B的压强相等,A容器恒容,随着反应的进行压强逐渐增大(气体物质的量增加);B容器恒压,压强不变;所以达平衡时压强一定是A中大,B中小,此反应压强减小平衡正向移动,所以B的反应平衡更靠右,反应的更多,吸热也更多。
②根据图3得到,900℃时反应产率已经比较高,温度再升高,反应产率的增大并不明显,而生产中的能耗和成本明显增大,经济效益会下降,所以选择900℃为反应最佳温度。
(3)明显电池的负极为Al,所以反应一定是Al失电子,该电解质为氯化铝离子液体,所以Al失电子应转化为Al3+,方程式为:Al–3e–=Al3+(或2Al–6e–=2Al3+)。根据电池的正极反应,氧气再第一步被消耗,又在第二步生成,所以氧气为正极反应的催化剂。将方程式加和得到,总反应为:2Al+6CO2=Al2(C2O4)3。


科目:高中化学 来源: 题型:
【题目】某化学小组为测定一定质量的某铜铝混合物中铜的质量分数,设计了如下实验方案:
方案Ⅰ:铜铝混合物![]() 测定生成气体的体积
测定生成气体的体积
方案Ⅱ:铜铝混合物![]() 测定剩余固体的质量
测定剩余固体的质量
下列有关判断中不正确的是
A. 溶液A和B均可以是盐酸或氢氧化钠溶液
B. 溶液A和B均可以选用稀硝酸
C. 若溶液B选用氯化铁溶液,则实验难以实现
D. 实验方案Ⅱ更便于实施
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1998年诺贝尔化学奖授予科恩和波普尔,以表彰他们在理论化学领域作出的重大贡献.他们的实验和理论能共同协力探讨分子体系的性质.下列说法正确的是
A.未来化学的研究方向是经验化B.化学不需要再做实验
C.化学不再是纯实验学科D.化学不做实验,就什么都不知道
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向20mL0.1mol·L-1H3PO2溶液中滴加0.1mol·L-1的NaOH溶液,滴定曲线如图1,含磷微粒物质的量浓度所占分数(δ)随pH变化关系如图2。下列说法不正确是
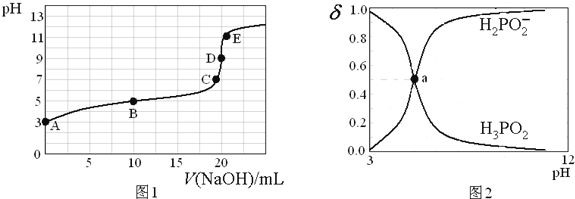
A. H3PO2的电离方程式为H3PO2![]() H2PO2-+H+ Ka≈10-5
H2PO2-+H+ Ka≈10-5
B. B点时,溶液中存在关系:2c(H+)+c(H2PO2-)=2c(OH-)+c(H3PO2)
C. C点时,溶液中存在关系:c(Na+)+c(H+)=C(H2PO2-)+c(OH-)
D. D点时,溶液中微粒浓度大小关系:c(Na+)>c(H2PO2-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中反应①是制备SiH4的一种方法,其副产物MgCl2·6NH3是优质的镁资源。回答下列问题:

(1)MgCl2·6NH3所含元素的简单离子半径由小到大的顺序(H-除外):_________________________,Mg在元素周期表中的位置:_____________________,Mg(OH)2的电子式:____________________。
(2)A2B的化学式为_______________。反应②的必备条件是_______________。上图中可以循环使用的物质有_______________。
(3)在一定条件下,由SiH4和CH4反应生成H2和一种固体耐磨材料_______________(写化学式)。
(4)为实现燃煤脱硫,向煤中加入浆状Mg(OH)2,使燃烧产生的SO2转化为稳定的Mg化合物,写出该反应的化学方程式:_______________。
(5)用Mg制成的格氏试剂(RMgBr)常用于有机合成,例如制备醇类化合物的合成路线如下:

依据上述信息,写出制备![]() 所需醛的可能结构简式:_______________。
所需醛的可能结构简式:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烟道气中的NOx是主要的大气污染物之一,为了监测其含量,选用如下采样和检测方法。回答下列问题:
Ⅰ.采样
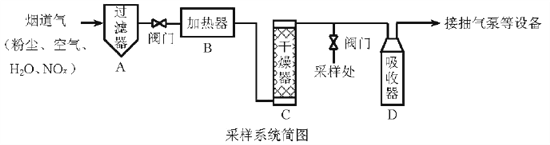
采样步骤:
①检验系统气密性;②加热器将烟道气加热至140℃;③打开抽气泵置换系统内空气;④采集无尘、干燥的气样;⑤关闭系统,停止采样。
(1)A中装有无碱玻璃棉,其作用是___________。
(2)C中填充的干燥剂是(填序号)___________。
a.碱石灰 b.无水CuSO4 c.P2O5
(3)用实验室常用仪器组装一套装置,其作用是与D(装有碱液)相同,在虚线框中画出该装置的示意图,标明气体的流向及试剂。

(4)采样步骤②加热烟道气的目的是___________。
Ⅱ.NOx含量的测定
将v L气样通入适量酸化的H2O2溶液中,使NOx完全被氧化为NO3,加水稀释至100.00 mL。量取20.00 mL该溶液,加入v1 mL c1 mol·L1 FeSO4标准溶液(过量),充分反应后,用c2 mol·L1 K2Cr2O7标准溶液滴定剩余的Fe2+,终点时消耗v2 mL。
(5)NO被H2O2氧化为NO3的离子方程式是___________。
(6)滴定操作使用的玻璃仪器主要有___________。
(7)滴定过程中发生下列反应:
3Fe2++NO3+4H+![]() NO↑+3Fe3++2H2O
NO↑+3Fe3++2H2O
Cr2O72 + 6Fe2+ +14H+ ![]() 2Cr3+ +6Fe3++7H2O
2Cr3+ +6Fe3++7H2O
则气样中NOx折合成NO2的含量为_________mg·m3。
(8)判断下列情况对NOx含量测定结果的影响(填“偏高” 、“偏低”或“无影响 ”)
若缺少采样步骤③,会使测试结果___________。
若FeSO4标准溶液部分变质,会使测定结果___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种可充电锂-空气电池如图所示。当电池放电时,O2与Li+在多孔碳材料电极处生成Li2O2-x(x=0或1)。下列说法正确的是

A. 放电时,多孔碳材料电极为负极
B. 放电时,外电路电子由多孔碳材料电极流向锂电极
C. 充电时,电解质溶液中Li+向多孔碳材料区迁移
D. 充电时,电池总反应为Li2O2-x=2Li+(1-![]() )O2
)O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在强酸性溶液中能大量共存并且溶液为无色透明的离子组是
A.Ba2+ Na+ NO3- S2-B.Mg2+ Cl- Al3+ SO42-
C.K+ Cl- HCO3- NO3-D.Ca2+ Na+ Fe3+ NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.工业上镁的制备是电解熔融的MgO
B.可用小苏打发酵面团制作馒头
C.高纯度的单质硅被广泛用于制作计算机芯片
D.热的纯碱可用于除油污
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com