
| 0.01mol/L×0.1L |
| 0.001mol/L |
| 0.01mol/L×0.1L+0.0001mol/L×xL |
| 0.1L+xL |
| 0.01mol/L×0.1L-0.01mol/L×yL |
| 0.1L+yL |


科目:高中化学 来源: 题型:
| A、标准状况下11.2LO2和16gO3中含有的氧原子数均为 NA |
| B、2.4g金属镁变成镁离子(Mg2+)时失去的电子数目的0.1NA |
| C、2g氢气所含原子数目为NA |
| D、1mol/L的CaCl2溶液中含有的Cl-为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、容器内的总压强不随时间变化 |
| B、X2的物质的量浓度不随时间变化 |
| C、X2、Y2、XY 的物质的量浓度之比为1:1:2 |
| D、单位时间内生成nmolX2,同时生成nmolY2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
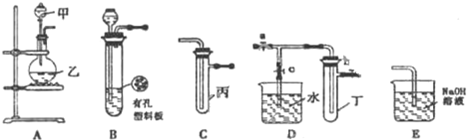
| 实验序号 | 实验操作 | 现象 | 结论 |
| Ⅰ | 将氯水滴入品红溶液 | 溶液褪色 | 氯气与水反应的产物有漂白性 |
| Ⅱ | 氯水中加入NaHCO3粉末 | 有无色气泡产生 | 氯气与水反应的产物具有较强的酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
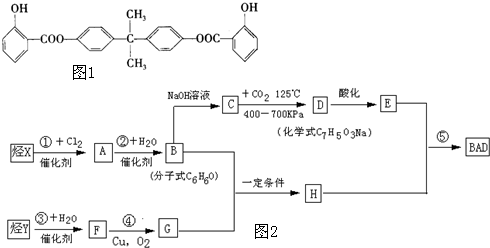
查看答案和解析>>
科目:高中化学 来源: 题型:
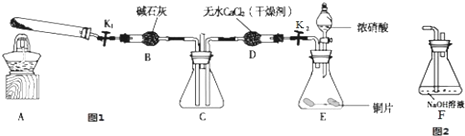
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯化钠溶液在电流作用下电离成钠离子和氯离子 |
| B、溶于水后能电离出氢离子的化合物一定是酸 |
| C、硫酸钡难溶于水,但硫酸钡属于电解质 |
| D、二氧化碳溶于水后所得物质能部分电离,故二氧化碳属于电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将1~2ml饱和FeCl3溶液逐滴滴到20ml 0.5 mol?L-1NaOH溶液中 |
| B、将1~2ml饱和FeCl3溶液逐滴加入到20ml沸水中,并继续加热至溶液呈红褐色后停止加热 |
| C、将1~2ml饱和FeCl3溶液逐滴加入到20ml冷水中,再加热至沸腾 |
| D、将1~2ml沸水加入到1~2ml FeCl3饱和溶液中,并用玻璃棒不断搅拌 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com