
| c(H+) |
| c(HSO3-) |
| c(H+) |
| c(HSO3-) |


 ��Ȥ������ҵ���ϿƼ�������ϵ�д�
��Ȥ������ҵ���ϿƼ�������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| ������ | Al��OH��3 | Fe��OH��3 | Fe��OH��2 | Ni��OH��2 |
| pH | 5.2 | 3.2 | 9.7 | 9.2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ���� | �����Լ� | ���ӷ���ʽ |
| SO42- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����⡢NaOH��Һ |
| B������Na2CO3��Һ |
| C��������Ӧ��ʯ����Һ |
| D���к͵ζ���pH��ֽ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| HX | HY | HZ | |
| Ũ��mol?L-1 | 0.1 0.5 | 1.0 1.5 | 2.0 2.5 |
| ����� | 0.3% 0.13% | 0.3% 0.24% | 0.5% 0.45% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A������������ɫ���ٸı� |
| B����������ѹǿ���ٸı� |
| C����λʱ���ڲ�1 mol H-H����ͬʱ����2 mol H-I�� |
| D�����������ܶȲ��ٸı� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
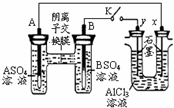 ijͬѧ����ͼ��ʾ��װ�ý������飮A��B Ϊ���ֳ������������ǵ������ο�����ˮ���� K �պ�ʱ���ڽ���Ĥ�� SO42-���������ƶ������з���������ǣ�������
ijͬѧ����ͼ��ʾ��װ�ý������飮A��B Ϊ���ֳ������������ǵ������ο�����ˮ���� K �պ�ʱ���ڽ���Ĥ�� SO42-���������ƶ������з���������ǣ�������| A���������Aǿ��B |
| B��B �ĵ缫��Ӧ��B-2eһ=B2+ |
| C��x�缫���� H2 ����������������Ӧ |
| D����Ӧ���ڣ�x �缫��Χ���ְ�ɫ���������ó����ܽ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A��H2O��g���TH2��g��+
| ||
| B��2H2��g��+O2��g���T2H2O��l����H=-484kJ?mol-1 | ||
C��H2��g��+
| ||
| D��2H2��g��+O2��g���T2H2O��g����H=+484kJ?mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
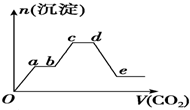 ��������CO2����ͨ��KOH��Ba��OH��2��KAlO2�Ļ����Һ�У����ɳ��������ʵ�������ͨ��CO2�������ϵ��ͼ��ʾ�����й���������Ӧ�����е���������ȷ���ǣ�������
��������CO2����ͨ��KOH��Ba��OH��2��KAlO2�Ļ����Һ�У����ɳ��������ʵ�������ͨ��CO2�������ϵ��ͼ��ʾ�����й���������Ӧ�����е���������ȷ���ǣ�������| A��Oa�η�Ӧ�Ļ�ѧ����ʽ��Ba��OH��2+CO2�TBaCO3��+H2O |
| B��ab����cd���������ķ�Ӧ��ͬ |
| C��de�γ�������������BaCO3������ʧ�� |
| D��bc�η�Ӧ�����ӷ���ʽ��2AlO2-+3H2O+CO2�T2Al��OH��3��+CO32- |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com