
��Cl2����ijЩ�����л���ʱ�����������HC1�����÷�ӦA����ʵ���ȵ�ѭ�����á�
��ӦA��4HCl��O2 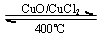 2Cl2��2H2O
2Cl2��2H2O
��֪����ӦA�У�4mol HCI���������ų�115.6kJ��������
��
�ж�����˵����ȷ����
| A����ӦA����H ����115��6 kJ��mol��1 |
| B��H2O��H��O ����HCl��H��Cl���� |
| C���ɢ��е������ж���Ԫ�صķǽ����Ա���Ԫ��ǿ |
| D���Ͽ�1 mol H��O ����Ͽ� 1 mol H��Cl �������������ԼΪ32kJ |
D
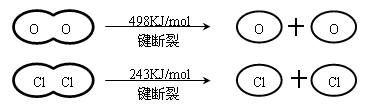
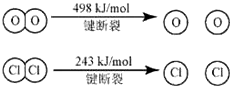
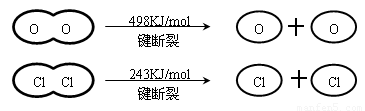
���������������Ӧ�Ⱦ��Ƕϼ����յ��������γɻ�ѧ�����ų��������IJ�ֵ��������4x��498kJ��2��243kJ��2��2��y����115.6kJ�����y��x��31.9������ѡ��D��ȷ��A��B����ȷ�����ܴ�С������Ϊ�ж���Ԫ�غ���Ԫ�طǽ�����ǿ�������ݣ�C����ȷ����ѡD��
���㣺���鷴Ӧ�ȵ��йؼ��㡢�жϺ�Ӧ��
�������������е��Ѷȵ����⣬���������ӱ��������ǿ������Ĺؼ�����ȷ���۵ĽǶ�ȥ���ⷴӦ�ȵļ��㣬����������ѧ���Ͻ�����˼ά�����ͷ�ɢ˼ά�������Լ�������û���֪ʶ���ʵ�������������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| CuO/CuCl | 400�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��Cl2����ijЩ�����л���ʱ�����������HCl�����÷�ӦA����ʵ���ȵ�ѭ�����ã�400�棬���������£���ӦA��4HCl+O2�T2Cl2+2H2O
��Cl2����ijЩ�����л���ʱ�����������HCl�����÷�ӦA����ʵ���ȵ�ѭ�����ã�400�棬���������£���ӦA��4HCl+O2�T2Cl2+2H2O

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| CuO/CuCl3 | 400�� |



 2Cl2��g��+2H2O��g����H=-115.6 KJ/mol
2Cl2��g��+2H2O��g����H=-115.6 KJ/mol 2Cl2��g��+2H2O��g����H=-115.6 KJ/mol
2Cl2��g��+2H2O��g����H=-115.6 KJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ||
| 400�� |
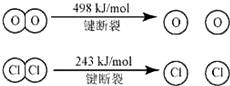
| A��16kJ | B��24kJ |
| C��32kJ | D��48kJ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�켪��ʡ�����и߶���ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��Cl2����ijЩ�����л���ʱ�����������HC1�����÷�ӦA����ʵ���ȵ�ѭ�����á�
��ӦA��4HCl��O2 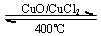 2Cl2��2H2O
2Cl2��2H2O
��֪����ӦA�У�4mol HCI���������ų�115.6kJ��������
��
�ж�����˵����ȷ����
A����ӦA����H ����115��6 kJ��mol��1
B��H2O��H��O ����HCl��H��Cl����
C���ɢ��е������ж���Ԫ�صķǽ����Ա���Ԫ��ǿ
D���Ͽ�1 mol H��O ����Ͽ� 1 mol H��Cl �������������ԼΪ32kJ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com