
可逆反应:N2 (g)+3H2 (g)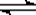 2NH3(g)正反应放热,下列说法错误的是
2NH3(g)正反应放热,下列说法错误的是
| A.使用催化剂可加快速率,提高生产效率 | B.N2不可能完全转化为NH3 |
| C.增大H2浓度可提高N2转化率 | D.达平衡时,N2与NH3浓度比为1:2 |
科目:高中化学 来源: 题型:
相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应: N2(g) +3H2(g) 2NH3(g) △H=-92.4 kJ/mol。
实验测得起始、平衡时的有关数据如下表:
| 容器编号 | 起始时各物质物质的量/mol | 平衡时反应中的能量变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出热量a kJ |
| ② | 2 | 3 | 0 | 放出热量b kJ |
| ③ | 2 | 6 | 0 | 放出热量c kJ |
下列叙述正确的是 ( )
A.放出热量关系:a < b < 92.4
B.三个容器内反应的平衡常数:③ > ① > ②
C.达平衡时氨气的体积分数:① > ③
D.N2的转化率:②> ① > ③
查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)恒温下,将a mol N2与bmol H2的混合气体通入一个固定容积的密闭容器中,发生可逆反应:N2(g)+3H2(g) =====2NH3(g)。
(1)若反应进行到某时刻t时,nt(N2)=13 mol,nt(NH3)=6 mol,计算a的值。
(2)反应达到平衡时,混合气体的体积为716.8 L(标准状况下),其中NH3的含量(体积分数)为25%,计算平衡时N2 的转化率。
查看答案和解析>>
科目:高中化学 来源:2014届福建省高一下学期期末模块测试化学试卷(解析版) 题型:选择题
在一定条件下,密闭容器中可发生可逆反应:N2(g) + 3H2(g)
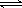 2NH3(g) 。
2NH3(g) 。
下列说法中,表明这一反应已经达到化学平衡状态的是( )
A.N2、H2、NH3的浓度相等 B.N2、H2、NH3的浓度不再变化
C.N2、H2、NH3在密闭容器中共存 D.反应停止,正、逆反应速率都等于零
查看答案和解析>>
科目:高中化学 来源:2011-2012年学福建省高二上学期期中考试化学试卷 题型:填空题
(14分,每空2分)
I.合成氨工业对国民经济和社会发展具有重要的意义。其原理为:
N2(g)+3H2(g)
 2NH3(g) △H= -92.4 kJ/mol 据此回答以下问题:
2NH3(g) △H= -92.4 kJ/mol 据此回答以下问题:
(1)为了提高氨气的产率,可以选择的方法是 _______ (填序号,错选扣分)。
① 升高温度 ② 增大压强 ③ 使用催化剂 ④ 及时分离出NH3
(2)对在密闭容器中进行的可逆反应:N2(g)+3H2(g) 2NH3(g),下列哪种情况下,
2NH3(g),下列哪种情况下,
说明该反应已经达到化学平衡状态____________________________________。
①N2的正反应速率是NH3的逆反应速率的1/2
②在恒容条件下,混合气体的压强保持不变
③N2、H2、NH3的物质的量之比为1:3:2
④单位时间内每生成3mol H2的同时有2mol NH3生成
⑤3mol N-N键断裂,同时有6mol N-H键断裂
(3)一定条件下,NH3在固定体积的密闭容器中发生分解反应(△H>0)并达平衡后,仅改变下表中反应条件x,该平衡体系中随x递增y递减的是________________(选填序号)。
|
选项 |
a |
b |
c |
d |
|
x |
温度 |
温度 |
加入H2的物质的量 |
加入NH3的物质的量 |
|
y |
NH3的物质的量 |
平衡常数K |
NH3的转化率 |
生成物物质的量总和 |
II.(1)在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生如下反应:
2IO3-+5SO32-+2H+===I2+5SO42-+H2O
生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率。
某同学设计实验如下表所示:
|
|
0.01mol·L-1 KIO3酸性溶液(含淀粉)的体积/mL |
0.01mol·L-1 Na2SO3溶液的体积/mL |
H2O的体积 /mL |
实验 温度 /℃ |
溶液出现蓝色时所需时间/s |
|
实验1 |
5 |
V1 |
35 |
25 |
--------- |
|
实验2 |
5 |
5 |
40 |
25 |
---------- |
|
实验3 |
5 |
5 |
V2 |
0 |
----------- |
该实验的目的是_______________________________________________________________
________________________________________________;
表中V1=___________mL.
(2)可逆反应C(s)+H2O(g)  H2(g)+CO(g),△H>0达到平衡后,改变某一外界条件(不改变物质的量的条件下),反应速率
H2(g)+CO(g),△H>0达到平衡后,改变某一外界条件(不改变物质的量的条件下),反应速率 与时间t的关系如右图。
与时间t的关系如右图。
①图中t4到t6段时引起平衡移动的条件可能是 ;
②图中表示平衡混合物中CO的含量最高的一段时间是 。
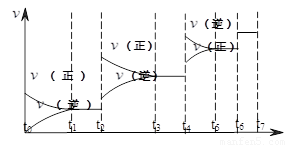
查看答案和解析>>
科目:高中化学 来源:2013届重庆市高二上学期期末考试化学试卷 题型:选择题
相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:
N2(g)+3H2(g) 2NH3(g)
△H=-92.6 kJ/moL。实验测得起始、平衡时有关数据如下表:
2NH3(g)
△H=-92.6 kJ/moL。实验测得起始、平衡时有关数据如下表:
容器编号 |
起始时各物质物质的量/mol |
达平衡时体系能量的变化 |
||
N2 |
H2 |
NH3 |
||
① |
1 |
3 |
0 |
放出热量:23.15kJ |
② |
0.9 |
2.7 |
0.2 |
放出热量:Q |
下列叙述错误的是( )
A.容器①、②中反应达平衡时,状态完全相同
B.①平衡时,N2的转化率为25%
C.容器②中达平衡时放出的热量Q<23.15 kJ
D.若向容器①加入2molN2、6molH2,则平衡时放出的热量23.15kJ <Q1<46.3 kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com