
【题目】电导率用于衡量电解质溶液导电能力的大小,与离子浓度和离子迁移速率有关。图1 为相同电导率盐酸和醋酸溶液升温过程中电导率变化曲线,图2 为相同电导率氯化钠和醋酸钠溶液升温过程中电导率变化曲线,温度均由22℃上升到70℃。下列判断不正确的是

A. 由曲线1可以推测:温度升高可以提高离子的迁移速率
B. 由曲线4可以推测:温度升高,醋酸钠电导率变化与醋酸根的水解平衡移动有关
C. 由图1和图2可以判定:相同条件下,盐酸的电导率大于醋酸的电导率,可能的原因是Cl-的迁移速率大于CH3COO-的迁移速率
D. 由图1和图2可以判定:两图中电导率的差值不同,与溶液中H+、OH-的浓度和迁移速率无关
【答案】D
【解析】
A.曲线1中盐酸溶液在升高温度的过程中离子浓度不变,但电导率逐渐升高,说明温度升高可以提高离子的迁移速率,故A正确;
B.温度升高,促进CH3COONa溶液中CH3COO-的水解,则由曲线3和曲线4可知,温度升高,醋酸钠电导率变化与醋酸根的水解平衡移动有关,故B正确;
C.曲线1和曲线2起始时导电率相等,但温度升高能促进醋酸的电离,溶液中离子浓度增加,但盐酸溶液的导电率明显比醋酸高,说明可能原因是Cl-的迁移速率大于CH3COO-的迁移速率,故C正确;
D.曲线1和曲线2起始时导电率相等,可知盐酸和醋酸两溶液中起始时离子浓度相等,包括H+和OH-浓度也相等,而随着温度的升高,促进醋酸的电离,醋酸溶液中的H+和OH-浓度不再和盐酸溶液的H+和OH-浓度相等,则两者的导电率升高的幅度存在差异,可能与溶液中H+、OH-的浓度和迁移速率有关,故D错误;
故答案为D。


 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案科目:高中化学 来源: 题型:
【题目】下列有关问题,与盐的水解有关的是( )
①NH4Cl与ZnCl2溶液可作焊接金属中的除锈剂
②用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂
③草木灰与铵态氮肥不能混合施用
④实验室盛放碳酸钠溶液的试剂瓶不能用磨口玻璃塞
⑤加热蒸干AlCl3溶液得到Al(OH)3固体
A. ①②③ B. ②③④
C. ①④⑤ D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸亚铁晶体(FeC2O4·2H2O)是一种淡黄色粉末,某课外小组利用下列装置检验草酸亚铁晶体受热分解的部分产物。
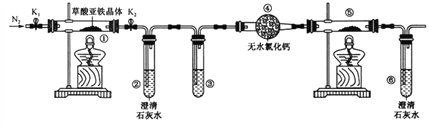
下列说法正确的是
A. 若③和⑤中分别盛放足量NaOH溶液和CuO,可检验生成的CO
B. 实验时只需要在装置①中反应结束后再通入N2
C. 若将④中的无水CaCl2换成无水硫酸铜可检验分解生成的水蒸气
D. 实验结束后,①中淡黄色粉末完全变成黑色,则产物一定为铁
查看答案和解析>>
科目:高中化学 来源: 题型:
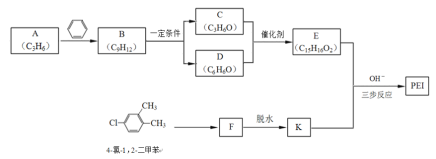
【题目】PEI[![]() ]是一种非结晶性塑料。其合成路线如下(某些反应条件和试剂已略去):已知:
]是一种非结晶性塑料。其合成路线如下(某些反应条件和试剂已略去):已知:
i. ![]()
ii.CH3COOH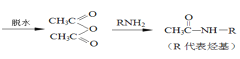 + CH3COOH
+ CH3COOH
(1)A为链状烃。A的化学名称为______。
(2)A→B的反应类型为______。
(3)下列关于D的说法中正确的是______(填字母)。
a.不存在碳碳双键 b.可作聚合物的单体 c.常温下能与水混溶
(4)F由4-氯-1,2-二甲苯催化氧化制得。F所含官能团有-Cl和______。
(5)C的核磁共振氢谱中,只有一个吸收峰。仅以2-溴丙烷为有机原料,选用必要的无机试剂也能合成C。写出有关化学方程式:_____
(6)以E和K为原料合成PEI分为三步反应。
![]()
写出中间产物2的结构简式: _______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋是一个巨大的化学资源宝库,下面是海水资源综合利用的部分流程图。

(1)步骤①中除去粗盐中杂质(Mg2+、SO![]() 、Ca2+),加入的药品顺序正确的是__________。
、Ca2+),加入的药品顺序正确的是__________。
A. NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸
B. BaCl2溶液→NaOH溶液→Na2CO3溶液→过滤后加盐酸
C. NaOH溶液→BaCl2溶液→Na2CO3溶液→过滤后加盐酸
D. BaCl2溶液→Na2CO3溶液→NaOH溶液→过滤后加盐酸
(2)步骤⑤中已获得Br2,步骤⑥中又用SO2的水溶液将Br2吸收,其目的是___________。
(3)写出步骤⑥中发生反应的离子方程式:_______________。
(4)把溴吹入到SO2的水溶液的气体X最可能用下面的___(填序号)。
A. 乙烯 B. 空气 C. 氩气 D. CO2
(5)由海水提溴过程中的反应可得出Cl-、SO2、Br-还原性由弱到强的顺序是___________。
(6)钛是航空、军工、电力等方面的必需原料。常温下钛不与非金属、强酸反应,红热时,却可与常见的非金属单质反应。目前大规模生产钛的方法是:TiO2、炭粉混合,在高温条件下通入Cl2制得TiCl4和一种可燃性气体。该反应的化学方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. HF、HCl、HBr、HI的熔沸点依次升高
B. CH4、CCl4都是含有极性键的非极性分子
C. CS2、H2S、C2H2都是直线形分子
D. 氯的各种含氧酸的酸性由强到弱排列为HClO>HClO2>HClO3>HClO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种可充电锂-空气电池如图所示。当电池放电时,O2与Li+在多孔碳材料电极处生成Li2O2-x(x=0或1)。下列说法正确的是

A. 放电时,多孔碳材料电极为负极
B. 放电时,外电路电子由多孔碳材料电极流向锂电极
C. 充电时,电解质溶液中Li+向多孔碳材料区迁移
D. 充电时,电池总反应为Li2O2-x=2Li+(1-![]() )O2
)O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项表述正确的是( )
A.次氯酸的电子式:![]()
B.表示中和热的热化学方程式:NaOH(aq)+HF(aq)=NaF(aq)+H2O(1)△H=-57.3kJmol
C.H2S电离的方程式为:H2S![]() 2H++S2-
2H++S2-
D.标准状况下,1.12L![]() 和1.12L
和1.12L ![]() ,均含有0.1NA个氧原子
,均含有0.1NA个氧原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以海水为原料可以提取金属镁,下图是某工厂从海水中提取镁的主要步骤。讨论以下相关问题

(1)在海水提镁的过程中如何实现对镁离子的富集,有三个学生提出自己的观点。
学生甲的观点:直接往海水中加入沉淀剂。
学生乙的观点:高温加热蒸发海水后,再加入沉淀剂。
学生丙的观点:利用晒盐后的苦卤水,再加入沉淀剂。
通过分析比较你认为学生_____的观点正确(填学生序号)。
(2)为了使镁离子沉淀下来,充分利用当地的贝壳(主要成分为碳酸钙)资源获得沉淀剂,加入的试剂①是_________(填化学式)。写出由贝壳制取试剂①的相关化学方程式:___________;
(3)加入试剂①后,能够分离得到Mg(OH)2沉淀的方法是_________(填标号字母)
A.蒸馏 B.分液 C.过滤 D.萃取
(4)加入的试剂②是________(填化学式)。工业过程中常常将蒸发结晶后的氯化镁水合物晶体再置于HCl气流中加热获得无水MgCl2,其目的是______________________________。
(5)写出由无水MgCl2制取金属镁的化学方程式_____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com