
【题目】一种可充电锂-空气电池如图所示。当电池放电时,O2与Li+在多孔碳材料电极处生成Li2O2-x(x=0或1)。下列说法正确的是

A. 放电时,多孔碳材料电极为负极
B. 放电时,外电路电子由多孔碳材料电极流向锂电极
C. 充电时,电解质溶液中Li+向多孔碳材料区迁移
D. 充电时,电池总反应为Li2O2-x=2Li+(1-![]() )O2
)O2
【答案】D
【解析】分析:本题考查的是电池的基本构造和原理,应该先根据题目叙述和对应的示意图,判断出电池的正负极,再根据正负极的反应要求进行电极反应方程式的书写。
详解:
A.题目叙述为:放电时,O2与Li+在多孔碳电极处反应,说明电池内,Li+向多孔碳电极移动,因为阳离子移向正极,所以多孔碳电极为正极,选项A错误。
B.因为多孔碳电极为正极,外电路电子应该由锂电极流向多孔碳电极(由负极流向正极),选项B错误。
C.充电和放电时电池中离子的移动方向应该相反,放电时,Li+向多孔碳电极移动,充电时向锂电极移动,选项C错误。
D.根据图示和上述分析,电池的正极反应应该是O2与Li+得电子转化为Li2O2-X,电池的负极反应应该是单质Li失电子转化为Li+,所以总反应为:2Li + (1-![]() )O2 = Li2O2-X,充电的反应与放电的反应相反,所以为Li2O2-X = 2Li + (1-
)O2 = Li2O2-X,充电的反应与放电的反应相反,所以为Li2O2-X = 2Li + (1-![]() )O2,选项D正确。
)O2,选项D正确。


 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】某无色工业废水中可能含有Na+、Mg2+、Al3+、Cu2+、Cl-、SO42-中的几种离子。
a.取10 mL该废水于试管中,加入足量的Ba(NO3)2溶液和稀硝酸,产生白色沉淀,充分反应后过滤,向滤液中加入AgNO3溶液无沉淀产生。
b.另取10 mL该废水于试管中,滴加NaOH溶液先产生白色沉淀,后部分沉淀溶解,生成沉淀的物质的量随加入NaOH的物质的量关系如图所示。
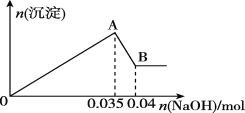
根据上述实验回答下列问题:
(1)该废水中一定不含有的离子有______________(填离子符号)
(2)实验室配制100 mL 1.0 mol·L-1的NaOH溶液时,用到的玻璃仪器除烧杯、玻璃棒、量筒外,还需要______________(填仪器名称)
(3)写出A→B过程中发生反应的离子方程式:______________
(4)该废水中,c(Al3+)=____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将3p%的硫酸与同体积的p%的硫酸混合得到q%的稀硫酸,则p、q的关系正确的是
A. q=2p B. q>2p C. q<2p D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组设计了如图装置,该装置能制取Cl2,并进行相关性质实验,且可利用装置G储存多余的氯气。

(1)A中发生反应的化学反应方程式为_________________________
(2)实验开始时,先打开分液漏斗旋塞和活塞K,点燃A处酒精灯,让氯气充满整个装置,再点燃E处酒精灯,回答下列问题:
①在装置C、D中能看到的实验现象分别是 __________________ 、_______________ ;
②在装置E的硬质玻璃管内盛有碳粉,发生氧化还原反应,产物为CO2和HCl,则E中发生反应的化学方程式为______________________________;
③装置F中球形干燥管的作用是____________________________;
(3)储气瓶b内盛放的试剂是______________________________;
(4)实验结束后,某同学想检验B瓶内液体是否完全与Cl2反应,可采用的方法是: __________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表达下列反应的离子方程式为
A. NaHCO3溶液中加足量Ba(OH)2溶液:2HCO3-+Ba2++2OH-![]() BaCO3↓+CO32-+2H2O
BaCO3↓+CO32-+2H2O
B. 少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO—![]() CaSO3↓+2HClO
CaSO3↓+2HClO
C. 用高锰酸钾标准溶液滴定草酸:2MnO4-+16H++5C2O42-![]() 2Mn2++10CO2↑+8H2O
2Mn2++10CO2↑+8H2O
D. 电解饱和食盐水获取烧碱和氯气: 2Cl—+ 2H2O![]() H2↑+ Cl2↑+2OH—
H2↑+ Cl2↑+2OH—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含 70% Cu、25% Al、4% Fe 及少量 Au、Pt 的合金,并设计出由合金制备硫酸铜和硫酸铝晶体的路线:

请回答下列问题:
(1)第①步Fe与过量的浓 HNO3 反应的离子方程式为_________,得到滤渣 1 的主要成分为__________。
(2)第②步加H2O2的作用是做氧化剂,将溶液中的 Fe2+氧化为Fe3+,用H2O2 做氧化剂的优点是______。
(3)滤渣 2 的主要成分是 Al(OH)3 和 Fe(OH)3,在生产中利用何种化学原理分离两种沉淀,写出反应的离子方程式_______。
(4)第③步蒸发所需玻璃仪器为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合物H ( )是一种聚酰胺纤维,广泛用于各种刹车片,其合成路线如下:
)是一种聚酰胺纤维,广泛用于各种刹车片,其合成路线如下:

已知:①C、D、G均为芳香族化合物,分子中均只含两种不同化学环境的氢原子。
②Diels-Alder反应:![]() 。
。
(1)生成A的反应类型是_______。D的名称是_______。F中所含官能团的名称是_______。
(2)B的结构简式是_______;“B→C”的反应中,除C外,另外一种产物是_______。
(3)D+G→H的化学方程式是______。
(4)Q是D的同系物,相对分子质量比D大14,则Q可能的结构有______种,其中核磁共振氢谱有4组峰,且峰面积比为1:2:2:3的结构简式为______(任写一种)。
(5)已知:乙炔与1,3-丁二烯也能发生Diels-Alder反应。请以1,3-丁二烯和乙炔为原料,选用必要的无机试剂合成 ,写出合成路线__________(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
,写出合成路线__________(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,0.1mol N2和0.3molH2在恒容的密闭容器中发生如下反应:N2(g)+3H2(g) ![]() 2NH3(g) △H<0下列说法不正确的是
2NH3(g) △H<0下列说法不正确的是
A. 达到平衡状态时,v正(NH3): v逆(N2)=2 : 1
B. c(N2):c(H2):c(NH3)=1:3:2时,说明反应已达到平衡状态
C. 容器内的压强不再变化时,说明反应已达到平衡状态
D. 升高温度时,v正(NH3)增大,v逆(NH3)增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com