
【题目】二茂铁可用作燃料的节能消烟剂、抗爆剂等,广泛应用于航天、化工等领域中。实验室制备二茂铁的装置示意图如图所示:
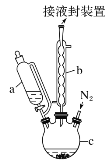
已知:Ⅰ.二茂铁熔点是173 ℃,在100℃时开始升华;沸点是249℃。
Ⅱ.制备二茂铁的反应原理是:2KOH+FeCl2+2C5H6=Fe(C5H5)2+2KCl+2H2O。
实验步骤为:
①在三颈烧瓶中加入25 g粉末状的KOH,并从仪器a中加入60 mL无水乙醚到烧瓶中,充分搅拌,同时通氮气约10 min;
②再从仪器a滴入5.5 mL新蒸馏的环戊二烯(C5H6,密度为0.95 g·cm-3),搅拌;
③将6.5 g无水FeCl2与(CH3)2SO(二甲亚砜,作溶剂)配成的溶液25 mL装入仪器a中,慢慢滴入仪器c中,45 min滴完,继续搅拌45 min;
④再从仪器a加入25 mL无水乙醚搅拌;
⑤将c中的液体转入分液漏斗中,依次用盐酸、水各洗涤两次,分液得橙黄色溶液;
⑥蒸发橙黄色溶液,得二茂铁粗产品。
回答下列问题:
(1)仪器c的名称是______。和普通分液漏斗相比,使用恒压滴液漏斗a的优点是______。
(2)步骤①中通入氮气的作用是_________。
(3)步骤⑤用盐酸洗涤的目的是_________。
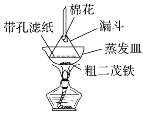
(4)步骤⑦是二茂铁粗产品的提纯,该过程在如图装置中进行,其操作名称为__________;为了确认得到的是二茂铁,还需要进行的一项简单实验是__________;
(5)若最终制得纯净的二茂铁4.3 g,则该实验的产率为________(保留小数点后一位)。
【答案】三颈烧瓶 平衡气压,有利于漏斗中的液体顺利流下 排尽装置中的空气,防止Fe2+被氧化 除去多余的KOH 升华 测定所得固体的熔点 58.4%
【解析】
根据仪器的结构确定仪器的名称,二茂铁中铁是+2价,易被空气中氧气氧化,据此分析通入氮气的目的,结合反应原理,分析三颈烧瓶中的剩余物得出盐酸洗涤的目的,根据环戊二烯计算二茂铁的理论产量,![]() ,以此计算。
,以此计算。
(1)根据仪器c的结构可知,c为三颈烧瓶,使用恒压滴液漏斗a可以平衡气压,有利于漏斗中的液体顺利流下,故答案为:三颈烧瓶;平衡气压,有利于漏斗中的液体顺利流下;
(2)二茂铁中铁是+2价,易被空气中氧气氧化,通入氮气可排尽装置中空气,防止实验过程中亚铁离子被氧化,故答案为:排尽装置中的空气,防止Fe2+被氧化;
(3)根据制备二茂铁的化学反应方程式,以及所给的KOH、氯化铁、环戊二烯的量,可知加入KOH应是过量的,因此步骤⑤中加入盐酸的目的是除去多余的KOH,故答案为:除去多余的KOH;
(4)根据已知信息,二茂铁在100℃时开始升华,再加上装置的示意图,蒸发皿上倒扣的漏斗,固体受热升华,再在漏斗上凝华,变成固体,为了确认是不是二茂铁,利用其物理或者化学性质,根据已知,二茂铁的熔点为173℃,可以测定其熔点,故答案为:升华;测定所得固体的熔点;
(5)环戊二烯的质量为5.5×0.95g=5.225g,FeCl2的质量为6.5g,根据反应方程式可知FeCl2过量,根据环戊二烯进行计算,理论上产生二茂铁的质量为![]() ,则产率为
,则产率为![]() ,故答案为:58.4%。
,故答案为:58.4%。


科目:高中化学 来源: 题型:
【题目】在如图所示的三个容积相同的容器①②③中进行如下反应:3A(g)+B(g) ![]() 2C(g) ΔH<0,若起始温度相同,分别向三个容器中通入3 mol A和1 mol B,则达到平衡时各容器中C物质的体积分数由大到小的顺序为( )
2C(g) ΔH<0,若起始温度相同,分别向三个容器中通入3 mol A和1 mol B,则达到平衡时各容器中C物质的体积分数由大到小的顺序为( )
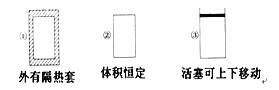
A. ③②①B. ③①②C. ①②③D. ②①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.淀粉、食用花生油、鸡蛋清都能发生水解反应
B.amol苯和苯甲酸混合物在足量氧气中完全燃烧后,消耗氧气7.5a mol
C.按系统命名法,有机物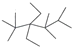 的命名为2,2,4,4,5-五甲基-3,3-二乙基己烷
的命名为2,2,4,4,5-五甲基-3,3-二乙基己烷
D.七叶内酯(![]() ),和东莨菪内酯(
),和东莨菪内酯(![]() ),都是某些中草药中的成分,它们具有相同的官能团,互为同系物
),都是某些中草药中的成分,它们具有相同的官能团,互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物Y能用于高性能光学树脂的合成,可由化合物X与2-甲基丙烯酰氯在一定条件下反应制得:( )
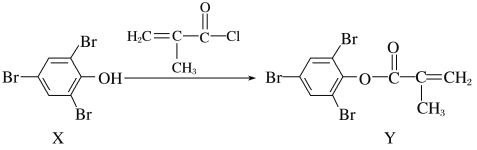
下列有关化合物X、Y的说法正确的是( )
A.X→Y的反应为加成反应
B.X分子中所有原子一定在同一平面上
C.X、Y均不能使酸性KMnO4溶液褪色
D.Y与Br2加成产物分子中含有手性碳原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有四种有机化合物:
甲:![]() 乙:
乙:![]() 丙:
丙:![]() 丁:
丁: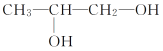
试回答:
(1)甲、乙、丁都含有的官能团的名称是________,四种物质中互为同分异构体的是________(填编号,下同)。
(2)1 mol甲、乙、丁分别与足量Na反应,生成H2最多的是_______________。
(3)丁与醋酸在催化剂作用下发生取代反应生成的酯有__________种。
(4)①写出甲与乙醇发生酯化反应的化学方程式:_____________________。
②写出乙与新制氢氧化铜悬浊液反应的化学方程式:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4NH3 (g) +5O2(g)![]() 4NO(g) +6H2O(g), △H=-a kJmol-1,在5L密闭容器投入1molNH3和1mol的O2,2分钟后NO的物质的量增加了0.4mol,下列说法正确的是
4NO(g) +6H2O(g), △H=-a kJmol-1,在5L密闭容器投入1molNH3和1mol的O2,2分钟后NO的物质的量增加了0.4mol,下列说法正确的是
A. 2分钟反应放出的热.量值小于0.1akJ
B. 用氧气表示2分钟的反应速率:v(O2)=0.05mol ·L-1 ·min-1
C. 2分钟内NH3的转化率是50%
D. 2分钟末 c(H2O)=0.6mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z均为短周期元素,W的最外层电子数与核外电子总数之比为7:17;X与W同主族;Y的原子序数是W和X的原子序数之和的一半;含Z元素的物质焰色反应为黄色。下列判断正确的是( )
A.气态氢化物的稳定性:X﹥W
B.金属性:Y﹥Z
C.最高价含氧酸的酸性:X﹥W
D.原子半径:Y﹥Z﹥X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法中,不正确的是![]()
A.![]() 的HCN溶液与
的HCN溶液与![]() 的NaOH溶液等体积混合,所得溶液中
的NaOH溶液等体积混合,所得溶液中![]() ,则a一定小于b
,则a一定小于b
B.常温下,![]() 溶液的
溶液的![]() ,则
,则![]()
C.常温下,![]() 的某酸溶液中,若
的某酸溶液中,若![]() ,则溶液中由水电离出的
,则溶液中由水电离出的![]()
D.在![]() 的
的![]() 溶液中加入少量NaOH固体,
溶液中加入少量NaOH固体,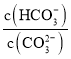 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近几年我国大面积发生雾霾天气,其主要原因是SO2、NOx等挥发性有机物等发生二次转化,研究碳、氮、硫及其化合物的转化对于环境的改善有重大意义。
(1)在一定条件下,CH4可与NOx反应除去NOx,已知有下列热化学方程式:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3 kJ·mol-1
②N2(g)+2O2(g)![]() 2NO2(g) △H=+67.0 kJ·mol-1
2NO2(g) △H=+67.0 kJ·mol-1
③H2O(g)=H2O(l) △H=-41.0 kJ·mol-1
则CH4(g)+2NO2(g) ![]() CO2(g)+2H2O(g)+N2 (g) △H=____kJ·mol-1;该反应在________(高温,低温,任何温度)下可自发进行
CO2(g)+2H2O(g)+N2 (g) △H=____kJ·mol-1;该反应在________(高温,低温,任何温度)下可自发进行
(2)若在T1℃、0.1 MPa条件下,往一密闭容器通入SO2和O2 [其中n(SO2):n(O2)= 2:1],测得容器内总压强与反应时间如下图所示。
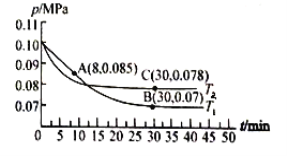
①图中A点时,SO2的转化率为________。
②在其他条件不变的情况下,测得T2℃时压强的变化曲线如图所示,则C点的正反应速率![]() 0(正)与A点的逆反应速率
0(正)与A点的逆反应速率![]() A(逆)的大小关系为
A(逆)的大小关系为![]() 0(正)_____
0(正)_____![]() A(逆) (填“>"、“<”或“ = ”)。
A(逆) (填“>"、“<”或“ = ”)。
③图中B点的平衡常数Kp=__________(MPa)-1。(Kp=压强平衡常数,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(3)利用脱氮菌可净化低浓度NO废气。当废气在塔内停留时间均为 90s 的情况下,测得不同条件下 NO 的脱氮率如图Ⅰ、Ⅱ所示。
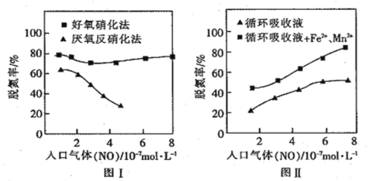
①由图I知,当废气中的NO含量增加时,宜选用______________法提高脱氮效率。
②图Ⅱ中,循环吸收液加入Fe2+、Mn2+提高了脱氮的效率,其可能原因为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com