
【题目】亚硝酰氯![]() ,熔点:
,熔点:![]() ,沸点:
,沸点:![]() 为红褐色液体或黄色气体,具有刺鼻恶臭味,遇水剧烈水解生成氮的两种氧化物与氯化氢,易溶于浓硫酸。是有机物合成中的重要试剂,常可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。其制备装置如图所示
为红褐色液体或黄色气体,具有刺鼻恶臭味,遇水剧烈水解生成氮的两种氧化物与氯化氢,易溶于浓硫酸。是有机物合成中的重要试剂,常可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。其制备装置如图所示![]() 其中III、IV中均为浓硫酸
其中III、IV中均为浓硫酸![]() :
:
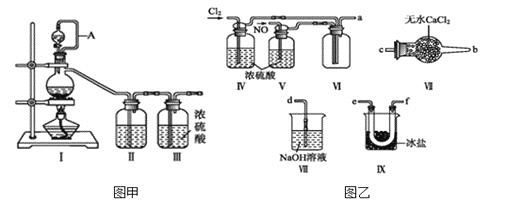
(1)用图甲中装置制备纯净干燥的原料气,补充下表中所缺少的药品。
| 装置Ⅰ | 装置Ⅱ | |
| 烧瓶中 | 分液漏斗中 | |
制备纯净 |
| 浓盐酸 |
|
制备纯净NO | Cu | 稀硝酸 |
|
(2)将制得的NO和![]() 通入图乙对应装置制备NOCl。
通入图乙对应装置制备NOCl。
![]() 装置连接顺序为
装置连接顺序为![]() ________
________![]() 按气流自左向右方向,用小写字母表示
按气流自左向右方向,用小写字母表示![]() 。
。
![]() 装置Ⅳ、Ⅴ除可进一步干燥NO、
装置Ⅳ、Ⅴ除可进一步干燥NO、![]() 外,还可以通过观察气泡的多少调节两种气体的流速。
外,还可以通过观察气泡的多少调节两种气体的流速。
![]() 有人认为可以将装置Ⅳ中浓硫酸合并到装置Ⅴ中,撤除装置Ⅳ,直接将NO、
有人认为可以将装置Ⅳ中浓硫酸合并到装置Ⅴ中,撤除装置Ⅳ,直接将NO、![]() 通入装置Ⅴ中,你同意此观点吗?_______
通入装置Ⅴ中,你同意此观点吗?_______![]() 填“同意”或“不同意”
填“同意”或“不同意”![]() ,原因是___________。
,原因是___________。
![]() 实验开始的时候,先通入氯气,再通入NO,原因为________________________。
实验开始的时候,先通入氯气,再通入NO,原因为________________________。
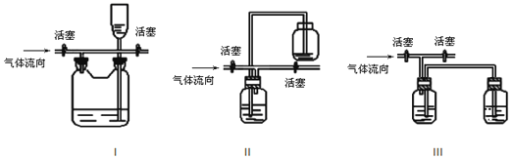
(3)有人认为多余的氯气可以通过下列装置暂时储存后再利用,请选择可以用作氯气的储气的装置 ______;
(4)装置Ⅶ吸收尾气时,NOCl发生反应的化学方程式为_______________________。
(5)有人认为装置Ⅶ中氢氧化钠溶液只能吸收氯气和NOCl,不能吸收NO,经过查阅资料发现用高锰酸钾溶液可以吸收NO气体,因此在装置Ⅶ氢氧化钠溶液中加入高锰酸钾,反应产生黑色沉淀,写出该反应的离子方程式:__________________________________。
(6)制得的NOCl中可能含有少量![]() 杂质,为测定产品纯度进行如下实验:称取
杂质,为测定产品纯度进行如下实验:称取![]() 样品溶于
样品溶于![]() 溶液中,加入几滴
溶液中,加入几滴![]() 溶液作指示剂,用足量硝酸酸化的
溶液作指示剂,用足量硝酸酸化的![]() 溶液滴定至产生砖红色沉淀,消耗
溶液滴定至产生砖红色沉淀,消耗![]() 溶液
溶液![]() 。则该样品的纯度为__________
。则该样品的纯度为__________![]() 保留1位小数
保留1位小数![]()
【答案】饱和食盐水 ![]()
![]() f可互换
f可互换![]() 不同意 NO与
不同意 NO与![]() 反应生成的NOCl可溶于浓硫酸 用
反应生成的NOCl可溶于浓硫酸 用![]() 排尽装置内的空气,以防NO与氧气反应 Ⅰ
排尽装置内的空气,以防NO与氧气反应 Ⅰ ![]()
![]()
![]()
【解析】
氯气与一氧化氮在常温常压下合成亚硝酰氯。图甲装置制备氯气,实验室用浓盐酸与二氧化锰制备,制得的氯气中混有氯化氢和水蒸气,先用饱和食盐水吸收除去HCl,再用浓硫酸干燥。由图甲制备NO,用铜和稀硝酸反应制备,制得的NO中可能混有硝酸、二氧化氮,先用水净化处理,再用浓硫酸干燥。将氯气和NO通过装置Ⅳ、Ⅴ除可进一步干燥NO、Cl2外,还可以根据气泡控制气体流速,在装置Ⅵ中发生反应,在冰盐中冷凝收集NOCl,氯气、NO以及NOCl均不能排放到空气中,用氢氧化钠溶液吸收,NOCl遇水易水解,故在收集装置和尾气处理装置之间需加一个干燥装置,以此解答该题。
(1)![]() 用
用![]() 与浓盐酸制备纯净干燥的氯气,需要除去氯气中的氯化氢杂质,装置Ⅱ中的试剂是饱和食盐水;
与浓盐酸制备纯净干燥的氯气,需要除去氯气中的氯化氢杂质,装置Ⅱ中的试剂是饱和食盐水;
![]() 用Cu与稀硝酸制备纯净干燥的NO,需要除去NO中的
用Cu与稀硝酸制备纯净干燥的NO,需要除去NO中的![]() 杂质,装置Ⅱ中的试剂是水;
杂质,装置Ⅱ中的试剂是水;
(2)![]() ,熔点:
,熔点:![]() ,沸点:
,沸点:![]() ,用冰盐水冷凝;亚硝酰氯遇水剧烈水解生成氮的两种氧化物与氯化氢,易溶于浓硫酸,要防止亚硝酰氯水解,氯气、NO有毒,所以用氢氧化钠溶液进行尾气处理,连接顺序是
,用冰盐水冷凝;亚硝酰氯遇水剧烈水解生成氮的两种氧化物与氯化氢,易溶于浓硫酸,要防止亚硝酰氯水解,氯气、NO有毒,所以用氢氧化钠溶液进行尾气处理,连接顺序是![]() ;
;
![]() 不同意此观点,因为氯气与一氧化氮在常温常压下反应生成NOCl,NOCl溶于浓硫酸,所以不能直接将NO、
不同意此观点,因为氯气与一氧化氮在常温常压下反应生成NOCl,NOCl溶于浓硫酸,所以不能直接将NO、![]() 通入装置Ⅴ中;
通入装置Ⅴ中;
![]() 用
用![]() 排尽装置内的空气,以防NO与氧气反应,所以实验开始的时候,先通入氯气,再通入NO;
排尽装置内的空气,以防NO与氧气反应,所以实验开始的时候,先通入氯气,再通入NO;
(3)装置Ⅰ中氯气进入下面的容器时,容器中的液体排入上面的容器,需要氯气时打开右侧活塞,水在重力作用下进入下面容器,将氯气排出,所以装置Ⅰ可以用作氯气的储气的装置;而Ⅱ、Ⅲ不能形成较大压强差,在使用氯气时不能将多余的氯气排出;
(4)由信息可知NOCl在水中剧烈水解生成NO、![]() 和HCl,类比
和HCl,类比![]() ,装置Ⅶ吸收尾气时,NOCl发生反应的化学方程式为
,装置Ⅶ吸收尾气时,NOCl发生反应的化学方程式为![]() ;
;
(5)黑色沉淀物为二氧化锰,则高锰酸钾被还原为![]() ,NO被氧化为硝酸根离子,因此对应的离子方程式为:
,NO被氧化为硝酸根离子,因此对应的离子方程式为:![]() ;
;
(6) n(AgNO3)=0.05L×0.40mol/L=0.02mol,根据氯原子守恒,由关系式NOClNaClAgNO3可知,n(NOCl)=0.02mol,则样品的纯度为![]() ×100%=80%。
×100%=80%。


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:
【题目】下列有机方程式书写正确的是
A.苯酚钠溶液中通入少量二氧化碳:![]() +CO2+H2O→
+CO2+H2O→![]() +HCO3-
+HCO3-
B.甲烷与氯气的取代反应:CH4+Cl2![]() CH2Cl2+H2
CH2Cl2+H2
C.用苯制硝基苯:![]() +HO—NO2
+HO—NO2![]()
![]() +H2O
+H2O
D.苯乙酮与足量氢气加成: ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中和热测定实验中,用50 mL 0.50 mol·L-1盐酸和50 mL 0.55 mol·L-1 NaOH进行实验,下列说法不正确的是
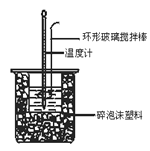
A. 改用60 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1 NaOH溶液进行反应,求出的中和热数值和原来相同
B. 测定过程中温度计至少用到3次,测量混合后的溶液温度时,应记录反应后的最高温度
C. 酸碱混合时,量筒中NaOH溶液应缓缓倒入小烧杯中,不断用环形玻璃搅拌棒搅拌
D. 装置中的大小烧杯之间填满碎泡沫塑料的作用是保温隔热、减少热量损失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)![]() 溶液呈碱性的原因是 ______
溶液呈碱性的原因是 ______ ![]() 写出有关的离子方程式
写出有关的离子方程式![]() ,将
,将![]() 溶液跟
溶液跟![]() 溶液混合,相关反应的离子方程式是 ______ .
溶液混合,相关反应的离子方程式是 ______ .
(2)现有浓度均为![]() 的
的![]() 溶液与
溶液与![]() 溶液,试回答下列问题:
溶液,试回答下列问题:
![]() 大小:
大小:![]() ______
______ ![]() 填
填![]() 、
、![]() 、
、![]() ;
;
![]() 微粒种类:
微粒种类:![]() ______
______ ![]()
![]() 填
填![]() 、
、![]() 、
、![]() ;
;
![]() 两溶液分别加入
两溶液分别加入![]() 固体,恢复到原温度,
固体,恢复到原温度,![]() 溶液中的
溶液中的![]()
______ ![]() 填“增大、减小或不变”
填“增大、减小或不变”![]() 、
、![]() 溶液中的
溶液中的![]() ______
______ ![]() 填“增大、减小或不变”
填“增大、减小或不变”![]() .
.
(3)常温下,甲为![]() 的HA溶液,
的HA溶液,![]() ;乙为
;乙为![]() BOH溶液,且溶液中
BOH溶液,且溶液中![]()
![]() 请分别写出甲、乙两溶液中溶质的电离方程式 ______ 、 ______ .
请分别写出甲、乙两溶液中溶质的电离方程式 ______ 、 ______ .
(4)相同条件下,对于浓度均为![]() 的NaCl溶液和
的NaCl溶液和![]() 溶液,溶液中的离子总数:NaCl溶液 ______
溶液,溶液中的离子总数:NaCl溶液 ______ ![]() 溶液
溶液![]() 填
填![]() 、
、![]() 、
、![]() .
.
(5)物质的量浓度相同的![]() 氨水
氨水![]() 氯化铵
氯化铵![]() 碳酸氢铵
碳酸氢铵![]() 硫酸氢铵
硫酸氢铵![]() 硫酸铵五种溶液中
硫酸铵五种溶液中![]() 由大到小的顺序是
由大到小的顺序是![]() 填写编号
填写编号![]() _____
_____
(6)浓度均为![]() 的6种溶液:
的6种溶液:![]()
![]()
![]()
![]()
![]()
![]() ,溶液pH值由小到大的顺序是
,溶液pH值由小到大的顺序是![]() 填写编号
填写编号![]() ______ .
______ .
(7)在钢铁发生的吸氧腐蚀中正极上的电极反应式为 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某离子晶体晶胞的结构如图所示。X(●)位于立方体顶点,Y(○)位于立方体中心。试
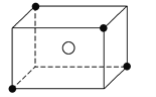
(1)晶体中每个Y同时吸引着__个X,每个X同时吸引着__个Y,该晶体的化学式为____________。
(2)晶体中每个X周围与它最接近且距离相等的X共有___个。
(3)晶体中距离最近的2个X与1个Y形成的夹角∠XYX是____。
(4)设该晶体的摩尔质量为Mg·mol-1,晶体密度为ρg·cm-3,阿伏加德罗常数的值为NA,则晶体中两个距离最近的X中心间距为___cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷重整时涉及以下两个反应
① CH4(g) + H2O(g) ![]() CO(g) +3H2(g) 平衡常数K1
CO(g) +3H2(g) 平衡常数K1
② CO (g) + H2O(g) ![]() CO2(g) + H2(g) 平衡常数K2
CO2(g) + H2(g) 平衡常数K2
它们的平衡常数随温度的变化如图所示,下列说法正确的是( )

A.反应①、②都是放热反应
B.两曲线交点表示此时①、②两反应速率相等
C.相同温度下,CH4(g)+2H2O(g) ![]() CO2(g) +4H2(g)的平衡常数为K1+K2
CO2(g) +4H2(g)的平衡常数为K1+K2
D.相同条件下,增大反应①、②中水蒸气的浓度,CH4、CO的转化率均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化合物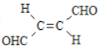 ,下列叙述正确的有( )
,下列叙述正确的有( )
A.分子间可形成氢键B.分子中既有极性键又有非极性键
C.分子中有7个![]() 键和1个
键和1个![]() 键D.C原子的杂化方式是sp2和sp3
键D.C原子的杂化方式是sp2和sp3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SnCl4是一种极易水解的化合物,它的制备需要在无水的条件下,密闭的装置中进行。若用常规(系统的体积较大)方法进行多实验缺点比较多,下图采用微型实验进行SnCl4 的制备,解决了常规方法的弊端(己知:SnCl4的熔点为-33℃,沸点为114.1℃)。
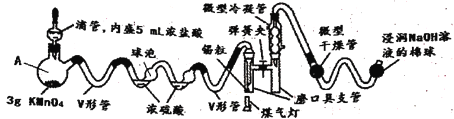
(1)将已干燥的各部分仪器按图连接好后,需要进行的操作为________________________。
(2)V形管的作用是________________________________________________________。
(3)下列说法中正确的是_____
A.仪器A的名称为蒸馏烧瓶
B.为了充分干燥氯气,浓硫酸的体积应大于球泡的体积
C.操作时应先滴加浓盐酸,使整套装置内充满黄绿色气体,再用煤气灯加热
D.生成的SnCl4蒸气经冷却聚集在磨口具支管中
E.微型干燥管中的试剂可以是碱石灰、五氧化二磷或无水氯化钙等
(4)实验中0.59锡粒完全反应制得1.03g SnCl4,则该实验的产率为_____________(计算结果保留一位小数)。
(5)SnCl4遇氨及水蒸气的反应是制作烟幕弹的原理,反应的化学方程式为_______________。
(6)该微型实验的优点是________________________________________________(任写两条)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胡椒乙酸是合成许多药用生物碱的重要中间体,以苯酸为原料制备胡椒乙酸的合成路线如图所示。回答下列问题:
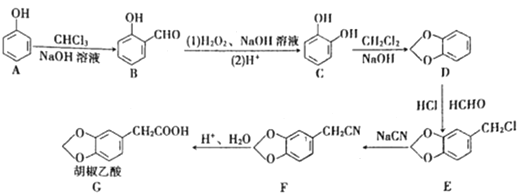
(1)下列关于有机物B的说法正确的是______![]() 填字母
填字母![]() 。
。
a.能与FeCl3溶液发生显色反应 b.核磁共振氢谱中只有3组峰
c.能发生银镜反应 d.能与溴水发生加成反应
(2)有机物C的名称是______,C→D的反应类型是______。
(3)胡椒乙酸(G)的分子式为______,G所含官能团的名称为______。
(4)E生成F的化学方程式为______。
(5)W是G的芳香族化合物同分异构体,0.5molW与足量碳酸氢钠溶液反应生成1molCO2,则W的结构共有______(不含立体异构)种,其中苯环上有2个取代基,且核磁共振氢谱有5组峰的结构简式为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com