
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.常温常压下,16g O2和32g O3的混合物中,含有O原子数共为3NA
B.标准状况下,1mol Na2O和1mol Na2O2的混合物中,含有离子总数为7NA
C.1 mol NaBH4中离子键的数目为2NA
D.若用K35ClO3与H37Cl作用,则发生KClO3+6HCl=KCl+3C12↑+3H2O,35Cl失去电子,37Cl得到电子,生成3molC12中有1mol35Cl
 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源:2016-2017学年黑龙江、吉林省两省六校高一上期中化学试卷(解析版) 题型:选择题
在酸性溶液中能大量共存,并且溶液为无色透明的是( )
A.K+、Ca2+、HCO3-、Cl- B.Cu2+、Na+、NO3-、Cl-
C.Na+、K+ 、Mg2+、SO42- D.Mg2+、Fe3+、Cl-、OH-
、Mg2+、SO42- D.Mg2+、Fe3+、Cl-、OH-
查看答案和解析>>
科目:高中化学 来源:2017届广东省惠州市高三上第三次调研化学试卷(解析版) 题型:实验题
如图A、B、C、D、E五组仪器(图中a、b、c表示止水夹)可以根据需要组装成不同实验装置.某兴趣小组的同学利用这些实验仪器进行实验,请对其方案进行完善或评价.

(1)将B、C、E相连,用浓硫酸和浓盐酸可制取氯化氢,装在分液漏斗中的试剂是 ,该实验尾气吸收装置设计有何不妥? ;改正后将B、D、E装置相连,用D装置中的丁试管收集满氯化氢气体,使烧杯中的水进入试管丁的操作是 。
(2)将A、C、E相连,并在丙中加入适量水,即可制得氯水,将所得氯水分为两份,进行ⅠⅡ两个实验,实验操作、现象、结论如下表所示:
序号 | 实验操作 | 现象 | 结论 |
Ⅰ | 将氯水滴入品红溶液 | 品红溶液褪色 | 氯气与水反应的产物有漂白性 |
Ⅱ | 氯水中加入碳酸氢钠粉末 | 有无色气泡产生 | 氯气与水反应的产物有具有酸性 |
请你评价:实验I推出的相应的结论是否合理? ;若不合理,请说明理由,〔若合理则无需填写) 。实验Ⅱ推出的结论是否合理? ;若不合理,请说明理由,(若合理则无需填写) 。
(3)研究表明,用ClO2气体对自来水消毒效果比用Cl2更好.市售的一种新型消毒剂含两种成分,分别是NaClO3和Na2C2O4.两种成分在溶液中混合便产生ClO2,反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2017届广东省高三上第二次段考化学试卷(解析版) 题型:选择题
下列离子方程式正确的是 ( )
A.Cl2与水反应:Cl2+ H2O = Cl-+ClO-+ 2H+
B.Fe溶于稀硝酸:2Fe+6H+ = 2Fe3++3H2↑
C.烧碱溶液中加入铝片:2Al+2OH-+2H2O = 2AlO2-+3H2↑
D.在稀氨水中通入过量CO2:2NH3·H2O+CO2 = 2NH4++CO32-+H2O
查看答案和解析>>
科目:高中化学 来源:2017届甘肃省定西市通渭县高三上学期期末化学试卷(解析版) 题型:实验题
某校化学兴趣小组为研究Cl2单质的性质,设计如图所示装置进行实验.装置III中夹持装置已略去,其中a为干燥的品红试纸,b为湿润的品红试纸.

(1)实验室以二氧化锰和浓盐酸制备氯气的化学方程式是: ;
(2)加入药品前,检查Ⅰ中气体发生 装置气密性的操作是: ;
装置气密性的操作是: ;
(3)装置Ⅱ的作用是 ;
(4)实验过程中,装置Ⅳ中的实验现象为 ;发生反应的化学方程式为 ;
(5)实验结束后,该组同学在装置Ⅲ中观察b的红色退去,但是并未观察到“a无明显变化”这一预期现象,为了达到这一目的,你认为应在 之间还需添加洗气瓶(选填装置序号),该装置的作用是  ;
;
(6)装置Ⅴ的目的是防止尾气污染空气,写出装置Ⅴ中发生反应的离子方程式 .
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三上联考二化学卷(解析版) 题型:实验题
锌焙砂是锌精矿经焙烧后所得的产物,主要含ZnO、ZnSO4,有少量FeO、CuO、NiO杂质,是炼锌最主要的原料。某科研小组设计了如下提取金属锌的实验流程:
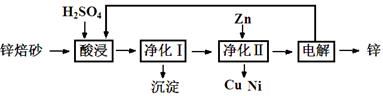
(1)酸浸时需要240 mL 4 mol·L-1稀H2SO4,用18.4 mol·L-1浓硫酸配制该稀H2SO4过程
中用到的玻璃仪器除烧杯、量筒、胶头滴管外,还要 、 ;酸浸得到的溶液中除Zn2+、Ni2+外,还含有的金属阳离子是 、 (填离子符号)。
(2)净化Ⅰ需要加入H2O2,加入H2O2时发生的离子反应方程式是 ;反应后控制溶液pH为4即沉淀完全,沉淀的主要成分是 。
(3)净化Ⅱ得到的Cu、Ni,需要进行洗涤操作,检验是否洗涤干净的方法是 ;本流程中可以循环利用的物质除锌外还有 、 。
(4)可用电解沉积硫酸锌溶液的方法制备锌,若在在阳极产生13.44L(标准状况下) 氧气,在阴极析出锌的质量为 。
(5)上述工艺中,如果不设计 “净化Ⅱ”,对提取金属锌造成的影响是____________________。
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三上联考二化学卷(解析版) 题型:选择题
在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g) + Y(g)  2Z(g) △H<0,一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g) △H<0,一段时间后达到平衡,反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是
A.0~2min的平均速率ν(Z) = 2.0×10-3mol·L-1·min-1
B.其他条件不变,降低温度,反应达到新平衡前ν(逆)>ν(正)
C.该温度下此反应的平衡常数K =1.44
D.其他条件不变,再充入0.2molZ,平衡时X的体积分数增大
查看答案和解析>>
科目:高中化学 来源:2017届北京市海淀区高三上学期期末化学试卷(解析版) 题型:选择题
新制氢氧化铜存在平衡:Cu(OH)2 + 2OH— Cu(OH)42—(深蓝色)。某同学进行下列实验:
Cu(OH)42—(深蓝色)。某同学进行下列实验:

下列说法不正确的是
A. ①中出现蓝色沉淀
B. ③中现象是Cu(OH)2 + 2OH— Cu(OH)42—正向移动的结果
Cu(OH)42—正向移动的结果
C. ④中现象证明葡萄糖具有还原性
D. 对比②和④可知Cu(OH)2氧化性强于Cu(OH)42—
查看答案和解析>>
科目:高中化学 来源:2017届广东省深圳市三校高三上学期第一次联考化学卷(解析版) 题型:选择题
氰氨基化钙(CaCN2)是一种重要的化工原料,制备CaCN2的化学方程式为:CaCO 3+2HCN = CaCN2+CO↑+H2↑+CO2↑则在该反应中( )
3+2HCN = CaCN2+CO↑+H2↑+CO2↑则在该反应中( )
A.氢元素被氧化,碳元素被还原
B.CaCN2是氧化产物,H2为还原产物
C.HCN仅作氧化剂
D.CO为氧化产物,H2为还原产物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com