
如图A、B、C、D、E五组仪器(图中a、b、c表示止水夹)可以根据需要组装成不同实验装置.某兴趣小组的同学利用这些实验仪器进行实验,请对其方案进行完善或评价.

(1)将B、C、E相连,用浓硫酸和浓盐酸可制取氯化氢,装在分液漏斗中的试剂是 ,该实验尾气吸收装置设计有何不妥? ;改正后将B、D、E装置相连,用D装置中的丁试管收集满氯化氢气体,使烧杯中的水进入试管丁的操作是 。
(2)将A、C、E相连,并在丙中加入适量水,即可制得氯水,将所得氯水分为两份,进行ⅠⅡ两个实验,实验操作、现象、结论如下表所示:
序号 | 实验操作 | 现象 | 结论 |
Ⅰ | 将氯水滴入品红溶液 | 品红溶液褪色 | 氯气与水反应的产物有漂白性 |
Ⅱ | 氯水中加入碳酸氢钠粉末 | 有无色气泡产生 | 氯气与水反应的产物有具有酸性 |
请你评价:实验I推出的相应的结论是否合理? ;若不合理,请说明理由,〔若合理则无需填写) 。实验Ⅱ推出的结论是否合理? ;若不合理,请说明理由,(若合理则无需填写) 。
(3)研究表明,用ClO2气体对自来水消毒效果比用Cl2更好.市售的一种新型消毒剂含两种成分,分别是NaClO3和Na2C2O4.两种成分在溶液中混合便产生ClO2,反应的化学方程式为 。
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源:2016-2017学年吉林省长春市五县高二上期末化学试卷(解析版) 题型:填空题
在一定条件下,在密闭容器中充入1molSO2与2molNO2发生反应:SO2(g)+NO2(g)  SO3(g)+NO(g) △H=-42kJ·mol-1。请回答下列问题。
SO3(g)+NO(g) △H=-42kJ·mol-1。请回答下列问题。
(1)恒温恒容下,在反应平衡体系中再充入一定量SO2,则NO2的平衡转化率__________(填“增大”、“不变”或“减小”,下同)。
(2)恒温恒压下,在反应平衡体系中再充入一定量SO2,则NO2的平衡浓度_________。
(3)恒容下,升高温度,上述反应的平衡常数K为_________。
(4)恒容下,降低温度,重新达到平衡时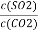 _________。
_________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江、吉林省两省六校高一上期中化学试卷(解析版) 题型:选择题
① 过滤 ② 蒸发 ③ 溶解 ④ 向容量瓶转移液体
A. ①和② B. ①和③ C. ③和④ D. ①和④
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江、吉林省两省六校高二上期中化学试卷(解析版) 题型:选择题
在101KPa时,已知热化学方程式S(s)+O2(g) = SO2(g) △H= -297.23kJ/mol,分析下列说法中不正确的是
A.硫的燃烧热为297.23 kJ/mol
B.S(g)+O2(g)== SO2(g)放出的热量大于297.23 kJ
SO2(g)放出的热量大于297.23 kJ
C.S(g)+O2(g)==SO2(g) 放出的热量小于297.23 kJ
D.形成1mol SO2的化学键所释放的总能量大于断裂1molS(s)和O2(g)的化学键所吸收的总能量
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江、吉林省两省六校高二上期中化学试卷(解析版) 题型:选择题
在醋酸的下列性质中,可以证明它是弱电解质的是
A.1mol/L的醋酸溶液中H+浓度约为10-3mol/L
B.醋酸能与水以任意比互溶
C.10mL 1mol/L的醋酸恰好与10mL 1mol/L NaOH溶液完全反应
D.醋酸的导电性比强酸溶液弱
查看答案和解析>>
科目:高中化学 来源:2017届广东省惠州市高三上第三次调研化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值.下列叙述中正确的是( O-16 N-16 )( )
A.1 mol甲基(CH3-)所含的电子数分别为10NA
B.标准状况下,22.4 L四氯化碳中含有C-Cl键的数目为4NA
C.常温常压下,1 mol分子式为C2H6O的有机物中,含有C-O键的数目为NA
D.46g 由NO2和N2O4组成的混合气体中,含有的原子总数为3NA
查看答案和解析>>
科目:高中化学 来源:2017届广东省高三上第二次段考化学试卷(解析版) 题型:实验题
晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
①高温下用炭还原二氧化硅制得粗硅;
②粗硅与干燥HCl气体反应制得SiHCl3:Si+3HCl SiHCl3+H2;
SiHCl3+H2;
③SiHCl3与过量H2在1000~1100 ℃反应制得纯硅。
已知:SiHCl3能与H2O强烈反应,在空气中易自燃。
请回答下列问题:
(1)第①步制备粗硅的化学方程式为_____________________。
(2)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):

①装置B中的试剂是________。装置C中的烧瓶需要加热,其目的是_________________。
②反应一段时间后,装置D中观察到的现象是________________,装置D中发生反应的化学方程式为__________________________。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及__________________________。
④SiHCl3的电子式为________,SiHCl3与H2O反应的化学方程式为:_________________。
查看答案和解析>>
科目:高中化学 来源:2017届甘肃省定西市通渭县高三上学期期末化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.常温常压下,16g O2和32g O3的混合物中,含有O原子数共为3NA
B.标准状况下,1mol Na2O和1mol Na2O2的混合物中,含有离子总数为7NA
C.1 mol NaBH4中离子键的数目为2NA
D.若用K35ClO3与H37Cl作用,则发生KClO3+6HCl=KCl+3C12↑+3H2O,35Cl失去电子,37Cl得到电子,生成3molC12中有1mol35Cl
查看答案和解析>>
科目:高中化学 来源:2017届广东省肇庆市高三上学期二模化学试卷(解析版) 题型:推断题
[化学—选修5:有机化学基础]有机物F是一种香料,其合成路线如图所示:

(1)A的名称为 ,试剂X的结构简式为 ,步骤Ⅵ的反应类型为 。
(2)步骤Ⅰ的反应试剂和条件分别为 、 。
(3)步骤Ⅱ反应的化学方程式为 。
(4)满足括号中条件(①苯环上只有两个取代基,②能与FeCl3溶液发生显色反应,③能发生水解反应和银镜反应)的E的同分异构体有 种,其中核磁共振氢谱峰面积比为6︰2︰2︰1︰1的分子的结构简式为 。
(5)依据题中信息,完成以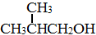 为原料制取
为原料制取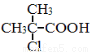 的合成路线图。
的合成路线图。
合成路线图示例如下:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com