
【题目】在下列化学反应中,既有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键形成的是
A.2Na2O+2H2O=4NaOH
B.Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑
C.2Na2O2+2H2O=4NaOH+O2↑
D.NH4Cl+NaOH![]() NaCl+NH3↑+H2O
NaCl+NH3↑+H2O
【答案】C
【解析】
化学反应的实质是旧化学键的断裂和新化学键的形成。有离子键、极性键、非极性键断裂,说的是反应物含有离子键、极性键、非极性键,有离子键、极性键、非极性键形成,说的是生成物含有离子键、极性键、非极性键。
A.反应物中Na2O由离子键构成,水由极性键构成,反应物不含非极性键,生成物NaOH含离子键和极性键,生成物不含非极性键,A错误;
B.反应物中Mg3N2由离子键构成,水由极性共价键构成,反应物中不含非极性键,生成物中氢氧化镁含离子键和极性键,氨气含极性键,生成物不含非极性键,B错误;
C.反应物中Na2O2含有离子键和非极性键,H2O含极性键,生成物中NaOH含有离子键和极性键,O2含非极性键,C正确;
D.反应物中NH4Cl含有离子键和极性键,NaOH中含离子键和极性键,生成物中NaCl由离子键构成,氨气由极性键构成,水由极性键构成,生成物没有非极性键,D错误。
答案选C。


科目:高中化学 来源: 题型:
【题目】活性氧化锌(ZnO)广泛用于橡胶、涂料、陶瓷、电子等行业,以粗氧化锌(主要成分为ZnO,还含有少量MnO、CuO、FeO、Fe2O3等)为原料经深度净化可制备高纯活性氧化锌,其流程如图所示:
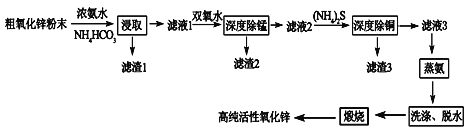
几种难溶物的Ksp:
物质 | Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | ZnS | CuS |
Ksp | 1.9×10-13 | 8.0×10-16 | 4.0×10-38 | 2.5×10-22 | 6.4×10-36 |
(1)将大小为66nm的高纯活性氧化锌粉末分散到水中,所得分散系为______。
(2)“浸取”过程中ZnO与NH3·H2O、NH4HCO3反应生成可溶性的Zn[(NH3)n]CO3和H2O。若有1mol ZnO溶解,则在该转化反应中参加反应的NH3·H2O和NH4HCO3物质的量之比的最大值为___________(已知:1≤n≤4)。
(3)“深度除锰”过程中双氧水可将“滤液1”中的Mn(OH)2转化为更难溶的MnO2·H2O,写出反应的化学方程式______________,“滤渣2”中存在的物质除了MnO2·H2O还可能含有_________(用化学式表示)。
(4)“深度除铜”过程中当溶液中![]() ≤2.0×10-6时,才能满足“深度除铜”的要求,若溶液中Zn2+浓度为1mol/L时,则最终溶液中S2-的浓度理论上的最小值为____mol/L。
≤2.0×10-6时,才能满足“深度除铜”的要求,若溶液中Zn2+浓度为1mol/L时,则最终溶液中S2-的浓度理论上的最小值为____mol/L。
(5)“蒸氨”过程中Zn[(NH3)n]CO3分解为ZnCO3·2Zn(OH)2·H2O、NH3和CO2。为了提高经济效益,请设计循环利用NH3和CO2方案_____________。
(6)“煅烧”时ZnCO3·2Zn(OH)2转变为高纯活性氧化锌,写出反应的化学方程式______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向1L 0.1mol·L1一元酸HR溶液中逐渐通入氨气(已知常温下NH3·H2O电离平衡常数K=1.76×10-5),使溶液温度和体积保持不变,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述正确的是
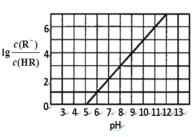
A.当c(R-)=c(HR)时,溶液必为中性
B.0.1mol·L-1HR溶液的pH为5
C.HR为弱酸,常温时随着氨气的通入,![]() 逐渐增大
逐渐增大
D.当通入0.1 mol NH3时,c(NH4+)>c(R-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有部分前36号元素的性质或原子结构信息如下表:
元素编号 | 元素的性质或原子结构 |
R | 基态原子的最外层有3个未成对电子,次外层有2个电子 |
S | 单质能与水剧烈反应,所得溶液a弱酸性 |
T | 基态原子3d轨道上有1个电子 |
X |
|
(1)R元素的第一电离能要大于其同周期相邻的元素,原因是______。
(2)S元素的常见化合价为_______,原因是_______。
(3)T元素的原子N电子层上的电子数为____________。
(4)X的轨道表示式违背了____________。用X单质、碱金属盐等可以制作焰火。燃放时,焰火发出五颜六色的光,请用原子结构的知识解释发光的原因:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】伞形酮可用作酸碱指示剂,可由雷琐苯乙酮和苹果酸在一定条件下反应制得。下列说法中错误的是
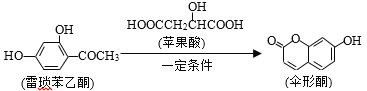
A.1mol伞形酮与足量NaOH溶液反应,最多可消耗3molNaOH
B.1 mol雷琐苯乙酮最多可与4 mol H2发生加成反应
C.苹果酸发生缩聚反应最多可生成2种高分子化合物
D.雷琐苯乙酮在一定条件下可发生氧化、取代、缩聚等反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某锂离子电池正极材料有钴酸锂(LiCoO2)、石墨和铝箔等,该电池充电时负极(阴极)反应为6C+xLi++xe- = LixC6,锂电池充放电过程中发生LiCoO2与Li1-xCoO2之间的转化。现利用以下工艺回收正极材料中的某些金属资源。
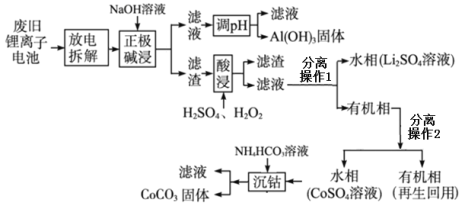
回答下列问题:
(1)放电时电池总反应方程式_______________;该工艺首先将废旧电池“放电处理”的目的除安全外还有_______________。
(2)写出“正极碱浸”过程中发生反应的离子方程式_______________。
(3) 分离操作1是_______________;“酸浸”步骤发生的氧化还原反应化学方程式是_______________。
(4)“酸浸”时若用盐酸代替H2SO4和H2O2的混合液,缺点是_______________。
(5)“沉钴”过程中的实验现象有_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢是重要而洁净的能源。要利用氢气作为能源,必须解决好储存氢气的问题。化学家研究出利用合金储存氢气的方法,其中镧(La)镍(Ni)合金是一种储氢材料,这种合金的晶体结构已经测定,其基本结构单元如图所示,则该合金的化学式可表示为( )
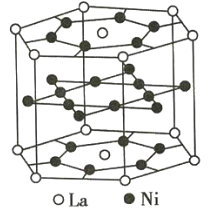
A.LaNi5B.LaNiC.La14Ni24D.La7Ni12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据杂化轨道理论和价电子对互斥理论模型判断,下列分子或离子的中心原子杂化方式及空间构型正确的是( )
选项 | 分子或离子 | 中心原子杂化方式 | 价电子对互斥理论模型 | 分子或离子的空间构型 |
A | H2O | sp1 | 直线形 | 直线形 |
B | BBr3 | sp2 | 平面三角形 | 三角锥形 |
C | PCl3 | sp2 | 四面体形 | 平面三角形 |
D | CO32- | sp2 | 平面三角形 | 平面三角形 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质发生变化时,所克服的粒子间作用力属于同种类型的是( )
A.碘与干冰受热变为气体
B.硝酸铵与硝酸受热分解变为气体
C.氯化钠与氯化氢溶解在水中
D.晶体钠熔化与冰融化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com