
NA表示阿伏伽德罗常数的值,下列叙述正确的是( )
A. 1mol —CH3(甲基)中含有的电子数为10NA
B. 标准状况下,22.4 L C3H8中含共价键的数目为8 NA
C. 标准状况下,22.4 L苯中含C—H数目为6 NA
D. 184g 甘油与足量的钠反应生成H2的数目为3 NA
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2017届陕西省高三下学期周练(四)理科综合化学试卷(解析版) 题型:选择题
青蒿素是一种高效、速效抗疟药,是中医药献给世界的一份礼物。屠呦呦因在发现、研究青蒿素方面做出的杰出贡献而获得2015年诺贝尔医学奖。青蒿素分子结构如下图,下列说法中正确的是

A.青蒿素能与热的NaOH溶液反应
B.青蒿素的分子式为C15H21O5
C.青蒿素分子结构中只含有极性键
D.青蒿素能使酸性KMnO4溶液、溴的CCl4溶液分别褪色
查看答案和解析>>
科目:高中化学 来源:2017届湖南省长沙市高三(实验班)第十次月考理综化学试卷(解析版) 题型:填空题
乙炔是重要的化工原料,广泛用于有机合成和氧炔焊等。生产乙炔的方法有多种,如电石法、甲烷裂解法等。
(1)在Co(NO3)2催化下,乙炔可被50%的浓硝酸(硝酸被还原为NO2)在20~70℃时直接氧化为H2C2O4·2H2O。
①该反应的化学方程式为________________________;
②实际生产中硝酸可循环利用而不被消耗,用方程式说明:___________________。
(2)电石法原理为:由石油焦与生石灰在电炉中生成电石CaC2(含Ca3P2、CaS等杂质), 电石与水反应生成C2H4(含PH3及H2S等杂质)。
①已知焦炭固体与氧化钙固体每生成l g CaC2固体,同时生成CO气体吸收7.25kJ的 热量,则该反应的热化学方程式为_____________________________________;
②用CuSO4溶液净化乙炔气体,去除PH3的反应之一为:4CuSO4+PH3+4H2O===4Cu↓+H3PO4+4H2SO4,每去除1 mol PH3,该反应中转移电子的物质的量为__________;
③反应H2S(aq)+Cu2+(aq)===CuS(s)+2H+(aq)的平衡常数为________________;(已知Ksp(CuS)=1.25×10-36,H2S的Kal=1×10-7,Ka2=1×10-13)
④电石法工艺流程简单、容易操作、乙炔纯度高,缺点是_______(举1例)。
(3)甲烷裂解法原理为:2CH4(g) C2H2(g)+3H2(g)△H,实验测得该反应的Kp(用平衡分压代替浓度计算的平衡常数,分压=总压×物质的量分数)与温度的关系如图所示:
C2H2(g)+3H2(g)△H,实验测得该反应的Kp(用平衡分压代替浓度计算的平衡常数,分压=总压×物质的量分数)与温度的关系如图所示:
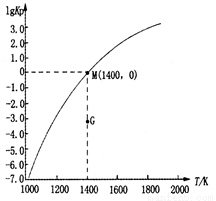
①该反应的△H________0(填“>”、“=”或“<”);
②图中G点v(正)______v(逆)(填“>”、“=”或“<”);
③M点时,若容器中气体的总物质的量为1 mol,则总压P与n(CH4)、n(C2H2)及n(H2)之间的关系为_________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二3月月考化学试卷(解析版) 题型:选择题
不能与溴水发生反应的是
①甲苯 ②邻甲基苯酚 ③亚硫酸 ④2-丁炔 ⑤AgNO3溶液 ⑥裂化汽油 ⑦1,3-丁二烯 ⑧ 环己烷 ⑨葡萄糖 ⑩乙醛
A. ①⑤ B. ①⑥⑨ C. ①⑧ D. ①②⑤⑦
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二3月月考化学试卷(解析版) 题型:选择题
氨分子中的一个氢原子被甲基取代后,所得甲胺(CH3NH2)的性质与氨相似,CH3NH2·H2O也是一元弱碱,25℃时电离常数Kb=4.0×10-5。现用0.0500mol/L的稀硫酸滴定l0mL 0.1000mol/L的甲胺溶液,溶液中c(OH-)的负对数(pOH)与所加稀硫酸的体积(V)的关系如图所示。下列说法正确的是
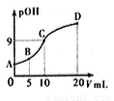
A. 甲胺在水中的电离方程式为:CH3NH2·H2O=CH3NH3++OH-,因此溶液呈碱性
B. C点所在溶液中 =2.5×10-5
=2.5×10-5
C. A、B、C、D四点溶液中,水电离出来的c(H+):C > D > B > A
D. B点溶液中存在c(CH3NH2·H2O)>c(CH3NH3+)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源:2017届天津市高三下学期第一次月考化学试卷(解析版) 题型:填空题
如表所示为元素周期表的一部分,参照元素①~⑨在表中的位置,请回答下列问题:
族 周期 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ⑧ | ⑨ | ② | ③ | ||||
3 | ④ | ⑤ | ⑥ | ⑦ | ||||
(1)③、④、⑦的原子半径由大到小的顺序是_________(用元素符号表示)。
(2)下列事实能说明②元素的非金属性比⑥元素的非金属性强的是__________。
a.②的单质与⑥元素的简单氢化物溶液反应,溶液变浑浊
b.在氧化还原反应中,1mol②单质比1mol⑥单质得电子多
c.②和⑥两元素的简单氢化物受热分解,前者的分解温度高。
(3)①、②两种元素按原子个数之比为1:1组成的常见液态化合物,在酸性溶液中能将Fe2+ 氧化,写出该反应的离子方程式 ___________________。
(4) 已知周期表中存在对角相似规则,如铍(Be)与铝化学性质相似,⑧的氧化物、氢氧化物也有两性,写出⑧的氢氧化物与④的最高价氧化物的水化物反应的化学方程式 _______________________。
(5)已知W+X=Y+Z(反应需要加热,),W、X、Y、Z分别是由①②⑨三种元素形成的四种10电子粒子(W、X为离子,Y、Z为分子),写出该化学方程式_________________。
(6)由表中元素形成的物质可发生如图中的反应,其中B、C、G是单质,B为黄绿色气体, D溶液显碱性。
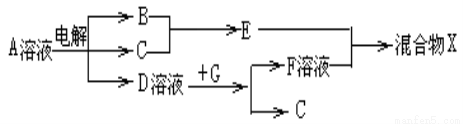
①写出D溶液与G反应的离子方程式______________________。
②写出检验A溶液中溶质的阴离子的方法____________________。
③常温下,若电解1L0.1mol/L的A溶液,一段时间后测得溶液pH为12(忽略溶液体积变化),则该电解过程中转移电子的物质的量为:________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省高一3月月考化学试卷(解析版) 题型:填空题
X、Y、Z、Q、R是五种短周期元素,原子序数依次增大。X、Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z、R分别是地壳中含量最高的非金属元素和金属元素。 请回答下列问题:
(1)五种元素原子半径由大到小的顺序是(写元素符号)________________。
(2)X与Y能形成多种化合物,其中相对分子质量最小的分子中只含有_________键(填“离子”、“极性”或“非极性”)。
(3)由以上某些元素组成的化合物A、B、C、D有如下转化关系: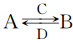 (在水溶液中进行)其中,C是溶于水显酸性的气体;D是淡黄色固体。
(在水溶液中进行)其中,C是溶于水显酸性的气体;D是淡黄色固体。
写出C的结构式:________;D的电子式:________。
①如果A、B均由三种元素组成,B为两性不溶物,由A转化为B的离子方程式为________________。
②如果A由三种元素组成,B由四种元素组成,A、B溶液均显碱性。由A转化为B的离子方程式为___________________。(提示:强酸弱碱盐显酸性,强碱弱酸显碱性)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省高一3月月考化学试卷(解析版) 题型:选择题
下列关于碱金属元素和卤素的说法中错误的是( )
A. 随核电荷数的增加,碱金属元素和卤素的原子半径都逐渐增大
B. 碱金属元素中,锂原子失去最外层电子的能力最弱;卤素中,氟原子得电子能力最强
C. 溴单质与水的反应比氯单质与水的反应更剧烈
D. 钾与水的反应比钠与水的反应更剧烈
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省成都市北湖校区高二3月月考化学试卷(解析版) 题型:选择题
下列有关问题,与盐类的水解无关的是( )
A. NH4Cl与ZnCl2溶液可作焊接金属中的除锈剂
B. 用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂
C. 实验室盛放氢氧化钠溶液的试剂瓶不能用磨口玻璃塞
D. 加热蒸干AlCl3溶液得到Al(OH)3固体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com