
【题目】下列生产、生活等实际应用,不能用勒夏特列原理解释的是( )
A. 溴水中有下列平衡Br2+H2O ![]() HBr + HBrO,当加入AgNO3溶液后溶液颜色变浅
HBr + HBrO,当加入AgNO3溶液后溶液颜色变浅
B. 合成氨工业中使用铁触媒做催化剂
C. 用饱和食盐水除去氯气中氯化氢杂质
D. 对2HI(g)![]() H2(g)+I2(g),保持容器体积不变,通入氢气可使平衡体系颜色变浅
H2(g)+I2(g),保持容器体积不变,通入氢气可使平衡体系颜色变浅
【答案】B
【解析】勒沙特列原理是:如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动。A、加入硝酸银溶液后,银离子消耗溴水中的溴离子,生成溴化银沉淀,溶液中溴离子浓度减小,平衡向着正向移动,能够用勒夏特列原理解释,错误;B、因为催化剂不影响化学平衡,不能用勒夏特列原理解释,正确;C、用饱和食盐水除去氯气中氯化氢杂质的反应原理为:Cl2+H2O![]() HCl+HClO,饱和食盐水中氯离子的浓度很高,氯离子的浓度高能使该反应平衡向逆向移动,能够用勒夏特列原理解释,错误;D、通入氢气后氢气浓度增大,平衡向着氢气浓度减小的方向移动,能够用勒夏特列原理解释,错误;故选B。
HCl+HClO,饱和食盐水中氯离子的浓度很高,氯离子的浓度高能使该反应平衡向逆向移动,能够用勒夏特列原理解释,错误;D、通入氢气后氢气浓度增大,平衡向着氢气浓度减小的方向移动,能够用勒夏特列原理解释,错误;故选B。


科目:高中化学 来源: 题型:
【题目】下列有关滴定的说法正确的是( )
A. 用25mL滴定管进行中和滴定时,用去标准液的体积为21.7mL
B. 用标准的KOH溶液滴定未知浓度的盐酸,配制标准溶液的固体KOH中有NaOH杂质,则结果偏低
C. 用C1mol/L酸性高锰酸钾溶液滴定V2mL未知浓度的H2C2O4溶液,至滴定终点用去酸性高猛酸钾溶液体积为V1mL,则H2C2O4溶液的浓度为![]() mol/L
mol/L
D. 用未知浓度的盐酸滴定已知浓度的NaOH溶液时,若读取读数时,滴定前仰视,滴定到终点后俯视,会导致测定结果偏低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按照如图所示接通线路,反应一段时间后,根据现象回答下列问题(假设所提供的电能可以保证反应顺利进行). 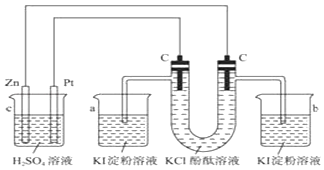
(1)标出电极名称:Zn;C(连Zn) .
(2)U型管中观察到的现象是 , 写出有关的反应方程式: .
(3)如果小烧杯中有0.508g碘析出,则烧杯中负极减轻 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.NaCl 溶液能导电,所以NaCl 溶液是强电解质
B.NaCl晶体不导电,但NaCl 是强电解质
C.液态氯化氢不导电,所以氯化氢是非电解质
D.氯气的水溶液能导电,所以氯气是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质之间能发生置换反应的是
A. 碘水加入氯化钠溶液中 B. 氯水加入碘化钠溶液中
C. 碘水加入溴化钠溶液中 D. 溴水加入氯化钠溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各表述与示意图一致的是( )
A.图①表示25℃时,用0.1 molL﹣1盐酸滴定20 mL 0.1 molL﹣1 NaOH溶液,溶液的p随加入酸体积的变化
B.图②中曲线表示反应2SO2(g)+O2(g)2SO3(g)△H<0正、逆反应的平衡常数K随温度的变化
C.图③表示10 mL 0.01 molL﹣1 KMnO4酸性溶液与过量的0.1 molL﹣1 H2C2O4溶液混合时,n(Mn2+)随时间的变化
D.图④中a、b曲线分别表示反应CH2═CH2(g)+H2(g)→CH3CH3(g)△H<0使用和未使用催化剂时,反应过程中的能量变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下。向20.00mL0.1mol/LHA溶液中滴入0.1mol/LNaOH溶液,溶液中由水电离出的氢离子浓度的负对数[-lgc水(H+)]与所加NaOH溶液体积的关系如图所示,下列说法不正确的是

A. 常温下,Ka(HA)约为10-5
B. M、P两点溶液对应的pH=7
C. b=20.00
D. M点后溶液中均存在c(Na+)>c(A-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质的沸点,按由低到高顺序排列的是 ( )
A. NH3、CH4、NaCl、Na
B. H2O、H2S、MgSO4、SO2
C. CH4、H2O、NaCl、SiO2
D. Li、Na、K、Rb、Cs
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com