
【题目】随着原子序数的递增,八种短周期元素(用字母x、y、z……表示)的原子半径相对大小、最高正价或最低负价的变化如下图所示。

请回答下列问题:
(1)f在周期表中的位置为______________;x形成的阴离子的结构示意图为_____________________。
(2)比较d、e常见离子的半径大小:__________________(填化学式,下同);比较g、h的最高价氧化物对应水化物的酸性强弱:_______________________。
(3)x、y、z、d四种元素能形成多种化合物。
①能形成离子化合物,其中一种x、y、z、d四种原子的个数比为5∶2∶1 ∶4,其化学式为__________________________。
②能形成共价化合物,写出其中一种的结构简式____________________________。
【答案】 第3周期ⅢA族 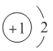 O2- > Na+ HC1O4 > H2SO4 NH4HC2O4 CO(NH2)2 (或各种氨基酸、HCNO等物质的结构简式)
O2- > Na+ HC1O4 > H2SO4 NH4HC2O4 CO(NH2)2 (或各种氨基酸、HCNO等物质的结构简式)
【解析】从图中的化合价、原子半径的大小及原子序数可知:x是H元素,y是C元素,z是N元素,d是O元素,e是Na元素,f是Al元素,g是S元素,h是Cl元素。
(1)f是Al元素,其原子序数为13,在元素周期表中位于第三周期ⅢA族,x是H元素,H-阴离子的结构示意图为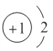 :故答案为:第三周期ⅢA族;
:故答案为:第三周期ⅢA族;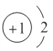 ;
;
(2)电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:O2->Na+;非金属性越强,最高价氧化物水化物的酸性越强,故酸性:HClO4>H2SO4,故答案为:O2->Na+;HClO4>H2SO4;
(3)①x、y、z、d四种元素能形成离子化合物,其中一种x、y、z、d四种原子的个数比为5∶2∶1 ∶4,则该化合物的化学式为NH4HC2O4,故答案为:NH4HC2O4;
②x、y、z、d四种元素能形成共价化合物,可以是各种氨基酸或尿素等,其中尿素的结构简式为CO(NH2)2,故答案为:CO(NH2)2。


科目:高中化学 来源: 题型:
【题目】CuBr是一种白色晶体,见光或潮湿时受热易分解,在空气中逐渐变为浅绿色。实验室制备CuBr的反应原理为:SO2+2CuSO4+2NaBr+ 2H2O=2CuBr↓+2H2SO4+Na2SO4,用下列装置进行实验,不能达到实验目的的是
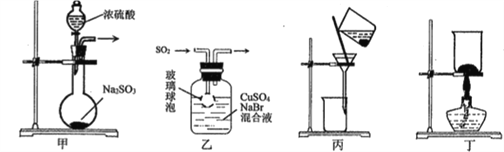
A. 用装置甲制取SO2 B. 用装置乙制取CuBr
C. 用装置丙避光将CuBr与母液分离 D. 用装置丁干燥CuBr
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C6H12O2的有机物A,它能在酸性条件下水解生成B和C,且B在一定条件下能转化成C,则有机物A的可能结构有( )
A. 1种B. 2种C. 3种D. 4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按下列实验方法能够达到要求的是( )
A.用10mL量筒量取7.50mL稀盐酸
B.用湿润的pH试纸测定NaCl溶液的酸碱性
C.用广泛pH试纸测得某碱溶液pH 12.7
D.用托盘天平称量出25.20g NaCl晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是________(填字母)。
A.C(s)+H2O(g)===CO(g)+H2(g) ΔH > 0
B.2H2(g)+O2(g)===2H2O(l) ΔH < 0
C.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH < 0
(2)固体氧化物燃料电池的工作原理如图所示,已知电池中电解质为熔融固体氧化物,O2-可以在其中自由移动。
①正极:________ (填“电极a”或“电极b”)。 O2-移向________极(填“正”或“负”)。

②当燃料气为C2H4时,其正极、负极反应式分别为
正极:______________________;负极:____________________。
(3)电解法可消除甲醇对水质造成的污染,原理是:通电将Co2+氧化成Co3+,然后Co3+将甲醇氧化成CO2和H+(用石墨烯吸附除去Co2+)。现用如图所示装置模拟上述过程,则除去甲醇的离子方程式为____________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学在化学工业有着广泛的应用,
(1)工业冶炼铝的化学方程式是___________________________;
(2)工业级氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换法膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示。
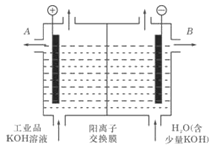
①该电解槽的阳极反应式是________________________;
②除去杂质后的氢氧化钾溶液从液体出口__________(填写“A”或“B”)导出。
(3)甲醇燃料电池由于其结构简单、能量转化率高、对环境无污染、可作为常规能源的替代品而越来越受到关注。其工作原理如右图,质子交换膜左右两侧的溶液均为1L 1.5 mol/L H2SO4 溶液。
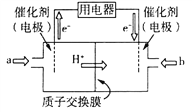
①通入气体a的电极是电池的________(填“正”或“负”)极,其电极反应式为___________________________________;
②当电池中有2 mol e-发生转移时,左右两侧溶液的质量差值为_________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种黄绿色气体.1974年,瑞典化学家舍勒发现软锰矿(主要成分是MnO2)和浓盐酸混合加热能制取氯气:MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O;通常也可用高锰酸钾和浓盐酸混合来制取氯气:2KMnO4+16HCl(浓)═2MnCl2+5Cl2↑+2KCl+8H2O;
MnCl2+Cl2↑+2H2O;通常也可用高锰酸钾和浓盐酸混合来制取氯气:2KMnO4+16HCl(浓)═2MnCl2+5Cl2↑+2KCl+8H2O;
(1)若用这两种方法制氯气,请比较,它们的发生装置使用的不同仪器是 .
(2)现将29g纯度为60%的软锰矿(主要成分MnO2)与足量的浓盐酸充分反应(杂质不参加反应),把反应后所得溶液稀释到200mL.计算:
①生成的Cl2在标准状况下的体积.
②稀释后溶液中MnCl2的物质的量浓度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A. 标准状况下,22.4 L庚烷的分子数约为NA
B. 1 L 0.1 mol·L-l的Na2S溶液中S2-和HS-的总数为0.1NA
C. 4.0 g H![]() O与D2O的混合物中所含中子数为2NA
O与D2O的混合物中所含中子数为2NA
D. 50 mL 12 mol·L-1盐酸与足量MnO2共热,转移的电子数为0.3NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com