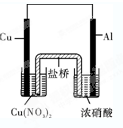
盐酸、硫酸、硝酸是中学阶段常见的三种强酸.现就三大强酸与金属铜的反应回答问题:
(1)我们知道,稀盐酸与Cu不反应,但在稀盐酸中加入H
2O
2后,则可使铜顺利溶解,该反应的化学反应方程式为
H2O2+Cu+2HCl=CuCl2+2H2O
H2O2+Cu+2HCl=CuCl2+2H2O
.
(2)在一定体积的18mol/L的浓硫酸中加入过量铜片,加热使之反应,被还原的硫酸为0.9mol.则浓硫酸的实际体积
大于
大于
(填“大于”“等于”或“小于”)100mL,你认为其主要原因是
随着反应的进行,浓硫酸变成稀硫酸,Cu和稀硫酸不反应
随着反应的进行,浓硫酸变成稀硫酸,Cu和稀硫酸不反应
.
(3)甲同学取一定量的铜与浓硝酸反应,发现有红棕色的气体生成,甲同学认为红棕色的气体一定是NO
2,但是测量该实验产生的红棕色气体的摩尔质量,发现并不等于46g/mol.请结合化学反应方程式分析所有可能的原因
硝酸由浓变稀,发生反应3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,同时存在反应2NO2?N2O4
硝酸由浓变稀,发生反应3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,同时存在反应2NO2?N2O4
.
(4)分别将等质量的铜片与等体积均过量的浓硝酸、稀硝酸反应,所得到的溶液前者呈绿色,后者呈蓝色,对于前者呈绿色的原因甲同学认为是该溶液中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了生成的气体.同学们分别设计了以下4个实验来判断两种看法是否正确.这些方案中可行的是(选填序号)
①③④
①③④
①加热该绿色溶液,观察颜色变化
②加水稀释绿色溶液,观察颜色变化
③向该绿色溶液中通入氮气,观察颜色变化
④向饱和硝酸铜溶液中通入浓硝酸与铜反应产生的气体,观察颜色.




 盐酸、硫酸和硝酸是中学常见的三种酸.
盐酸、硫酸和硝酸是中学常见的三种酸.