
【题目】黄铜矿是一种铜铁硫化物,化学式为CuFeS2,它是工业上炼铜的主要原料。某化学小组对其中的硫、铁、铜的含量进行测定。
Ⅰ.硫的含量测定。
(1)采用装置A,在高温下将10.0g矿样中的硫转化为SO2。
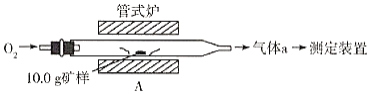
若在装置A反应中,氧化剂与还原剂的物质的量之比为19:6,灼烧后A中留下黑色固体,则反应的化学方程式为__________。
(2)将气体a通入测硫装置中(如图),然后采用沉淀法测定硫的含量。

①KMnO4溶液氧化SO2的离子方程式为________________。
②向反应后的溶液中加入过量的BaCl2溶液,过滤,洗涤沉淀并干燥,称重为23.3g,则该矿样中硫的质量分数为__________。
Ⅱ.铁、铜的含量测定。
向A中灼烧后的固体中加入稀硫酸,加热溶解,过滤,将滤液分为两等份。
(3)取其中一份加入过量的氨水生成沉淀{已知Cu(OH)2能溶于氨水生成[Cu(NH3)4]2+},过滤、洗涤、灼烧、称重为1.5 g。实验过程中,加入过量的氨水得到的沉淀是___________(填化学式);灼烧时除用到三脚架、酒精灯和玻璃棒外,还要用到________________。
(4)①将另一份溶液调至弱酸性,先加入NH4F,使Fe3+生成稳定的![]() ,其目的是_____
,其目的是_____
②加入过量KI溶液,使Cu2+生成CuI沉淀,同时析出定量的I2。
③再用1.00 molL-1 Na2S2O3标准溶液滴定生成的I2,以___________作指示剂。若消耗的Na2S2O3标准溶液为25.00 mL,则矿样中铜的质量分数是_________(已知I2 +2 Na2S2O3= Na2S4O6+2NaI)。
【答案】6CuFeS2 + 19O2![]() 2Fe3O4+6CuO+ 12SO2 5 SO2 +2H2O + 2
2Fe3O4+6CuO+ 12SO2 5 SO2 +2H2O + 2![]() =5
=5![]() +2Mn2+ +4H+ 32.0% Fe(OH)2,Fe(OH)3 坩埚(坩埚钳)、泥三角 Fe3+能氧化I-为I2,2Fe3++2I-=2Fe2++I2,干扰Cu2+的检测 淀粉 32.0%
+2Mn2+ +4H+ 32.0% Fe(OH)2,Fe(OH)3 坩埚(坩埚钳)、泥三角 Fe3+能氧化I-为I2,2Fe3++2I-=2Fe2++I2,干扰Cu2+的检测 淀粉 32.0%
【解析】
I硫含量的测定原理:高温下将矿样中的硫转化为SO2,之后利用高锰酸钾将二氧化硫氧化成硫酸根,在加入氯化钡溶液得到硫酸钡沉淀,通过硫酸钡沉淀的量来确定二氧化硫的含量;
Ⅱ.铁、铜的含量测定原理:取其中一份加入过量的氨水生成沉淀,Cu(OH)2能溶于氨水生成[Cu(NH3)4]2+,则得到的沉淀为:Fe(OH)2、Fe(OH)3,灼烧后得到氧化铁,称重以计算铁的量;将另一份溶液调至弱酸性,先加入NH4F,使Fe3+生成稳定的![]() ,再加入过量KI溶液,使Cu2+生成CuI沉淀,同时析出定量的I2,通过测定I2的量来间接测定铜的量。
,再加入过量KI溶液,使Cu2+生成CuI沉淀,同时析出定量的I2,通过测定I2的量来间接测定铜的量。
(1)O2是氧化剂,CuFeS2是还原剂,根据给出的物质的量之比和质量守恒,可写出A中发生反应的化学方程式为6CuFeS2 + 19O2![]() 2Fe3O4 +6CuO + 12SO2。
2Fe3O4 +6CuO + 12SO2。
(2)①KMnO4溶液氧化SO2的生成硫酸,高锰酸钾被还原为硫酸锰,结合电荷守恒、原子守恒和电子守恒书写离子方程式:2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+;
②向反应后的溶液中加入过量的BaCl2溶液,沉淀为BaSO4,由物料守恒知n(S)=n(BaSO4)=![]() =0.10 mol,m(S)=0.10 mol ×32 gmol-1=3.20 g,则矿样中硫的质量分数为
=0.10 mol,m(S)=0.10 mol ×32 gmol-1=3.20 g,则矿样中硫的质量分数为![]() ;
;
(3)根据分析可知加入过量的氨水得到的沉淀是氢氧化亚铁和氢氧化铁,灼烧固体在坩埚中,灼烧时除用到三脚架、酒精灯和玻璃棒外,还要用到坩埚、坩埚钳、泥三角;
(4)因为2Cu2+ +4I-=2CuI+I2,故2Cu2+~I2~2Na2S2O3,n(Cu2+)=n(Na2S2O3)=1.00 molL-1×25.00 × 10-3 L=0.025 mol,m(Cu)=0.025 mol ×64 gmol-1 =1.6 g,其在矿样中铜的质量分数是![]() 。
。


 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:
【题目】某科研人员提出HCHO与O2在羟基磷灰石(HAP)表面催化氧化生成CO2、H2O的历程,该历程示意图如下(图中只画出了HAP的部分结构)。下列说法不正确的是
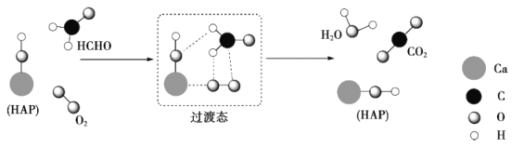
A.HAP能提高HCHO与O2的反应速率
B.根据图示信息,CO2分子中的氧原子全部来自O2
C.HCHO在反应过程中,有C-H键发生断裂
D.该反应可表示为: HCHO+O2![]() CO2+H2O
CO2+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金刚烷是一种重要的化工原料,工业上可通过下列途径制备:

请回答下列问题:
(1)环戊二烯分子中最多有__个原子共平面。
(2)金刚烷的分子式为__,其二氯代物有_种。
(3)已知烯烃能发生如下反应:
 。
。
请写出下列反应产物的结构简式:![]()
![]() __。
__。
(4)A是二聚环戊二烯的同分异构体,能使溴的四氯化碳溶液褪色,A经高锰酸钾酸性溶液加热氧化可以得到对苯二甲酸提示:苯环上的烷基(—CH3,—CH2R,—CHR2)或烯基侧链经高锰酸钾酸性溶液氧化得羧基,写出A所有可能的结构简式不考虑立体异构:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子中含有三个以上-OCH2CH2O-重复单元的有机物叫冠醚,18-冠-6的结构简式如图所示:

下列说法正确的是( )
A.18-冠-6中的“18”指分子含有18个碳原子,“6”指分子含有6个氧原子
B.该分子中所有原子可能共平面
C.该分子的一氯代物只有1种
D.该有机物的最简式和葡萄糖的相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锰及其化合物在现代工业、农业生产中有着广泛的应用,同时也是实验室中常用的重要试剂。
(1)KMnO4是强氧化剂,其溶液中c(H+)=c(OH-),则常温下0.01molL-1的HMnO4溶液的pH=_____________。
(2)MnS常用于除去污水中的Pb2+等重金属离子:Pb2+(aq)+ MnS(s)PbS(s)+Mn2+(aq),若经过处理后的水中c(Mn2+)=1 ×10-6 molL-1,则c(Pb2+)=______________[已知Ksp(PbS)=8×10-28、Ksp(MnS)=2×10-13]。
(3)锰是农作物生长的重要微量元素,用硫酸锰溶液拌种可使农作物产量提高10%~15%。某工厂利用回收的废旧锌锰干电池生成硫酸锰晶体(MnSO4H2O)的流程如图所示:
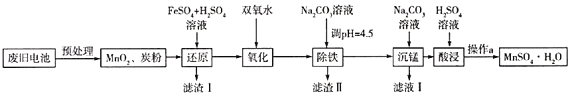
①MnSO4中含有的化学键类型有_______________。
②滤渣Ⅱ的主要成分是____________,滤渣Ⅰ是一种黑色单质,“还原”过程中氧化产物是Fe3+,写出相应反应的离子方程式_________,此反应中MnO2的转化率与温度之间的关系如图所示,则适宜的温度是______________(填字母)。
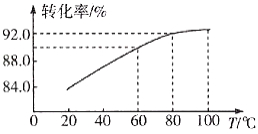
a.40 ℃ b.60 ℃ c.80 ℃ d.100 ℃
③“沉锰”中有无色无味的气体生成,还有MnCO36Mn(OH)25H2O生成,写出相应反应的化学方程式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锡酸钠(Na2SnO3)主要用作电镀铜锡合金和碱性镀锡的基本原料。锡精矿除含SnO2外,还含有少量WO3、S、As、Fe,一种由锡精矿制备锡酸钠的工艺流程如图:
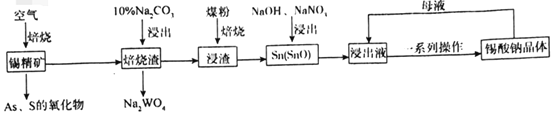
已知:①焙烧后,S、As变为挥发性氧化物而被除去,Fe变为Fe3O4;
②锡酸钠易溶于水,其溶解度随着温度的升高而降低。
请回答下列问题:
(1)Na2SnO3中锡元素的化合价为___,从焙烧渣中除去Fe3O4最简单的方法为___。
(2)WO3与Na2CO3溶液反应生成Na2WO4的化学方程式为___。
(3)加入煤粉焙烧可将SnO2还原为Sn或SnO,Sn或SnO在碱性条件下均能被NaNO3氧化为Na2SnO3,已知NaNO3的还原产物为NH3,则NaNO3氧化Sn的化学方程式为___。
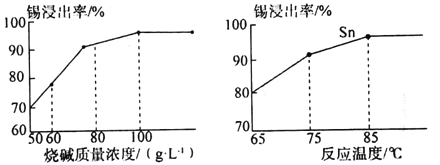
(4)如图为加入NaOH溶液和NaNO3溶液浸出时锡的浸出率与NaOH的质量浓度和反应时间的关系图,则“碱浸”时最适宜条件为___、___。
(5)从浸出液中获得锡酸钠晶体的“一系列操作”具体是指___,将母液返回至浸出液的目的为___。
(6)碱性镀锡以NaOH和Na2SnO3为电解液,以纯锡为阳极材料,待镀金属为阴极材料,镀锡时阳极反应的电极反应式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表述与示意图一致的是
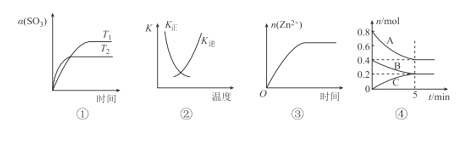
A.图①表示2SO3(g)=2SO2(g)+O2(g) △H>0,SO3的平衡转化率随温度、时间的变化
B.图②中曲线表示反应H2(g)+I2(g)=2HI(g) △H<0正、逆反应的平衡常数K随温度的变化
C.图③表示20 mL 0.1 mol/L稀盐酸与过量锌粒混合时,n(Zn2+)随时间的变化
D.图④反应从开始到平衡的平均反应速率v(B)=0.04molL-1min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五氧化二钒用作冶金添加剂,占五氧化二钒总消耗量的 80%以上,其次是用作有机化工的催化剂。为了增加V2O5 的利用率,我们从废钒催化剂(主要成分V2O5、VOSO4、K2SO4、SiO2 和Fe2O3 等) 中回收 V2O5 的一种生产工艺流程示意图:
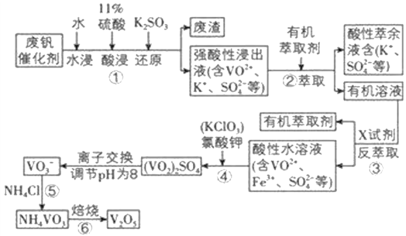
部分含钒物质在水中的溶解性如表所示,回答下列问题:
物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
(1)①中废渣的主要成分是 __________________________;①中V2O5 发生反应的离子方程式为 ___________________________ 。
(2)②、③中的变化过程可简化为(下式中的R 表示 VO2+或 Fe3+,HA 表示有机萃取剂的主要成分)R2(SO4)n(水层)+2nHA(有机层) 2RA(有机层)+ nH2SO4(水层)。②中萃取时必须加入适量碱,其原因是 ______________________;实验室进行萃取操作使用的玻璃仪器为 ______________________。
(3)实验室用的原料中V2O5 占 6%(原料中的所有钒已换算成 V2O5)。取 100 g 该废钒催化剂按工业生产的步骤进行实验,当加入 100 mL 0.1 molL -1 的KClO3 溶液时,溶液中的钒恰好被完全处理,假设以后各步钒没有损失,则该实验中钒的回收率是 __________________[M(V2O5)=182 gmol -1]。
(4)25℃时,取样进行实验分析,得到钒沉淀率和溶液 pH 之间的关系如表所示:
pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 |
钒沉淀率/% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.6 | 96.4 | 93.1 |
试判断在实际生产时,⑤中加入 NH4Cl 调节溶液的最佳 pH为____________;若钒沉淀率为 93.1%时不产生 Fe(OH)3 沉淀,则此时溶液中 c(Fe3+)≤____________ (已知:25℃时Ksp[Fe(OH)3]=2.6×10 -39)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒(Se)是第四周期第ⅥA族元素,是人体内不可或缺的微量元素,H2Se是制备新型光伏太阳能电池、半导体材料和金属硒化物的重要原料。
(1)已知:①2H2Se(g)+O2(g)![]() 2Se(s)+2H2O(l) ΔH1=akJ·mol-1
2Se(s)+2H2O(l) ΔH1=akJ·mol-1
②2H2(g)+O2(g)![]() 2H2O(l) ΔH2=bkJ·mol-1
2H2O(l) ΔH2=bkJ·mol-1
反应H2(g)+Se(s)![]() H2Se(g)的ΔH3=__kJ·mol-1(用含a、b的代数式表示)。
H2Se(g)的ΔH3=__kJ·mol-1(用含a、b的代数式表示)。
(2)T℃时,向一恒容密闭容器中加入3molH2和1molSe,发生反应H2(g)+Se(s)![]() H2Se(g)。
H2Se(g)。
①下列情况可判断反应达到平衡状态的是__(填字母代号)。
a.气体的密度不变 b.v(H2)=v(H2Se)
c.气体的压强不变 d.气体的平均摩尔质量不变
②当反应达到平衡后,将平衡混合气体通入气体液化分离器使H2Se气体转化为H2Se液体,并将分离出的H2再次通入发生反应的密闭容器中继续与Se反应时,Se的转化率会提高。请用化学平衡理论解释:_。
③以5小时内得到的H2Se为产量指标,且温度、压强对H2Se产率的影响如图1、图2所示:
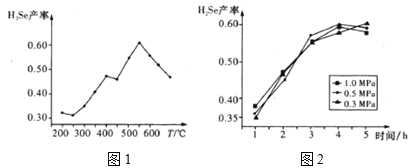
则制备H2Se的最佳温度和压强为__。
(3)已知常温下H2Se的电离平衡常数K1=1.3×10-4、K2=5.0×10-11,则NaHSe溶液呈__(填“酸性”或“碱性”),请通过计算数据说明__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com